
某学习小组为探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验
(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.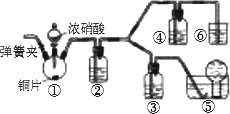
可供选择的药品:浓硝酸、
3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液、二氧化碳.已知氢氧化钠溶液不与
NO反应,能与NO2反应:2NO2+2NaOH![]() NaNO3+NaNO2+H2O.
NaNO3+NaNO2+H2O.
(1)实验过程中应尽量避免有害气体排放到空气中.装置③、④、⑥中盛放的药品依次是________.
(2)滴加浓硝酸之前要检验装置的气密性,具体的方法是:加入药品,打开弹簧夹后________________.
(3)装置①中发生反应的化学方程式是________________.
(4)装置②的作用是________,发生反应的化学方程式是________.
(5)该小组得出结论所依据的实验现象是________________.
(6)实验结束后,同学们发现装置①中的溶液呈绿色,而不显蓝色.甲同学认为是溶液中硝酸铜的质量分数较高所致,乙同学认为是溶液中溶解了生成的气体所致.为此同学们分别设计了以下4个实验判断上述两种看法是否正确.这些方案中可行的是________(选填字母).
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
|
答案: (1)3 mol/L稀硝酸、浓硝酸、氢氧化钠溶液(2)通入N2,一段时间后关闭弹簧夹,将装置⑤中的导管末端伸入倒置的烧瓶内 (3)Cu+4HNO3(浓) (4)将NO2转化为NO 3NO2+H2O (5)装置③中液面上方的气体仍为无色,装置④中液面上方的气体由无色变为红棕色 (6)acd 讲析:此实验的目的是证明浓硝酸能将 NO氧化成NO2,而稀硝酸不能氧化NO,实验的关键是避免装置中的氧气氧化NO.设计思路是:先制备NO,然后分别将气体通入浓硝酸、稀硝酸中观察现象.(1)分析装置图可知,装置⑤通过排水法收集气体,装置⑥用于吸收尾气.根据题目提示:NO不与氢氧化钠溶液反应而NO2与氢氧化钠溶液反应,说明装置⑥中盛有氢氧化钠溶液,逆推出装置④中盛有浓硝酸;装置⑤中盛有水,逆推出装置③中盛有稀硝酸,装置②用于提供NO,容器中应该盛有蒸馏水,因为铜与硝酸反应既产生NO2又生成NO. (2)通入N2以排尽装置中的空气,然后将装置⑤的导管末端伸入倒置的烧瓶中,以收集NO气体. (3)铜与浓硝酸反应生成Cu(NO3)2、NO2和H2O,当浓硝酸变成稀硝酸时,生成NO. (4)装置②中盛有蒸馏水,使NO2与水反应获得较为纯净的NO. (5)如果实验中装置③上方的气体仍为无色,证明稀硝酸不能氧化NO,同时若装置④上方产生红棕色气体,证明浓硝酸能将NO氧化为NO2. (6)装置①中的溶液呈绿色,可能是硝酸铜溶液的浓度较大,也可能是溶有二氧化氮的缘故.设计实验的思路有两条:一是除去溶液中混有的气体,如通入惰性气体排出NO2或加热使NO2逸出;或是向饱和硝酸铜溶液(该条件下的浓溶液)中通入NO2.值得注意的是:向溶液中加水,一方面硝酸铜溶液的浓度变小,另一方面NO2会溶于水,即同时改变了两个可能的因素,无法判断是哪个因素导致硝酸铜溶液的颜色变化. 点评:本实验以铜与浓硝酸的反应为载体,通过比较浓、稀硝酸氧化性的强弱,考查同学们设计定性实验的能力.在实验的过程中,应紧抓物质的性质,在排除干扰因素后得出结论. |


科目:高中化学 来源: 题型:阅读理解


| 猜想 | 验证方法 | 预测现象及结论 |
| 认为铜片中可能含有锌等杂质 |
| 猜想 | 预计验证方法 | 猜想的现象与结论 |
| 白色沉淀是氯化亚铜 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
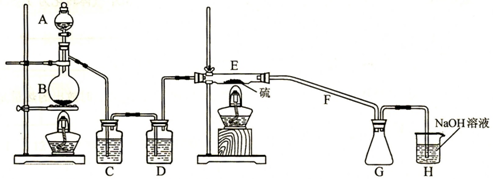
某学习小组为探究S和Cl2能否反应,经查资料获得信息,干燥的Cl2在110℃~140℃与S反应,可得S2Cl2粗品,由此设计如下试验装置(夹持装置未画出),请回答后面问题。

(1)实验过程中,使用分液漏斗滴加浓盐酸的操作是
(2)用反应方程式表示H装置的作用
(3)写出B中反应的离子方程式
(4)C、D中的试剂分别是 ,
(5)经检测粗品中含有SCl2,为减少SCl2的生成,关键的操作是
(6)F导管可能会发生堵塞,请在C、D之间设计一个防堵塞装置以免发生危险。(要求画出装置图,标出试剂名称,夹持装置不需画出)
查看答案和解析>>
科目:高中化学 来源: 题型:
(08茂名市二模)(本题12分)某学习小组为探究S和Cl2能否反应,经查资料获得信息,干燥的Cl2在110℃~140℃与S反应,可得S2Cl2粗品,由此设计如下试验装置(夹持装置未画出),请回答后面问题。

(1)实验过程中,使用分液漏斗滴加浓盐酸的操作是 (2分)(2)用反应方程式表示H装置的作用 (2分)(3)写出B中反应的离子方程式 (2分)(4)C、D中的试剂分别是 , (2分)(5)经检测粗品中含有SCl2,为减少SCl2的生成,关键的操作是 (2分)(6)F导管可能会发生堵塞,请在C、D之间设计一个防堵塞装置以免发生危险。(要求画出装置图,标出试剂名称,夹持装置不需画出) (2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com