
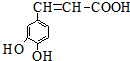
| A. | 与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物的结构有4种(不考虑空间异构) | |
| B. | 咖啡酸只能加聚成高分子化合物 | |
| C. | 咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 1mol该物质与足量的Na2CO3溶液反应,能消耗3 mol CO32- |
分析 该物质中含有酚羟基、碳碳双键和羧基,具有酚、烯烃和羧酸性质,能发生取代反应、显色反应、氧化反应、加成反应、加聚反应、酯化反应等,据此分析解答.
解答 解:A.该芳香族化合物有三个取代基,分别为两个酚羟基、一个-CH=CH-COOH,与该有机物符合条件的异构体为官能团在苯环上的位置不同,分别为: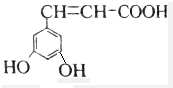 、
、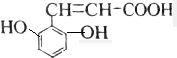 、
、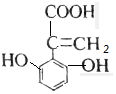 、还有与两羟基为间位关系的,另外也可以苯环上连有四个基团的,又有些种,共有6种,故A错误;
、还有与两羟基为间位关系的,另外也可以苯环上连有四个基团的,又有些种,共有6种,故A错误;
B.该分子中含有羧基和羟基,能发生缩聚反应生成高分子化合物,故B错误;
C.碳碳双键、苯环能和氢气在一定条件下发生加成反应,则咖啡酸最多可与4mol氢气发生加成反应,故C错误;
D.羧基能和碳酸钠反应生成二氧化碳,酚羟基能和碳酸钠反应生成碳酸氢钠,2mol羧基和碳酸钠反应生成1mol二氧化碳,所以1mol该物质与足量碳酸钠反应最多消耗3mol碳酸钠,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系式是解本题关键,涉及酚、烯烃和羧酸性质,注意酚羟基能和碳酸钠反应,但不能和碳酸氢钠反应.


科目:高中化学 来源: 题型:选择题
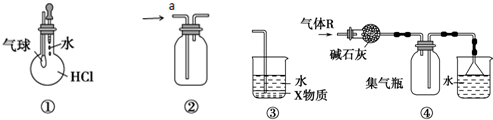
| A. | 装置①可验证HCl气体在水中的溶解性 | |
| B. | 装置②a口进气可用于收集CO2、Cl2或NO等 | |
| C. | 装置③中X为四氯化碳,可用于吸收氨气或氯化氢 | |
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的剧烈程度为L<Q | |
| C. | R最高价氧化物对应水化物是强酸 | |
| D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素在人体内不能被消化吸收,可帮助消化 | |
| B. | 可以用Si3N4、Al2O3制作高温结构陶瓷制品 | |
| C. | 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 | |
| D. | 禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
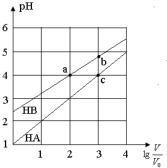 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| B. | 溶液中水的电离程度:a=c>b | |
| C. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c(B-)}{c(A-)}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | Na2SO4溶液 | AgNO3溶液 | 现象 | ||
| 体积/mL | 浓度/(mol•L-1) | 体积 | 浓度/(mol•L-1) | ||
| ① | 1 | 1 | 3滴 | 2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3滴 | 0.5 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3滴 | 0.1 | 有些许浑浊 |
| ④ | 1 | 1 | 3滴 | 0.01 | 无明显变化 |
| 编号 | AgNO3浓度/(mol•L-) | 稀释后Ag+浓度/(mol•L-1) | 混合溶液中SO42-的最小理论检出浓度/(mol•L-1) |
| ① | 2 | 0.2 | 0.0003 |
| ② | 0.5 | 0.0048 | |
| ③ | 0.1 | 0.01 | 0.12 |
| ④ | 0.01 | 0.001 |
| 编号 | AgNO3浓度/(mol•L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学视角是现代人所必须具备的科学素养中的重要组成部分 | |
| B. | 元素周期律的发现过程体现了物质分类思想和方法的运用 | |
| C. | 能源是现代文明的原动力,能源的开发和利用离不开化学 | |
| D. | 自然界一切物质都是由离子构成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、Cl-、OH- | B. | Ba2+、HCO3-、Cl-、Na+ | ||
| C. | Fe2+、SO42-、H+、NO3- | D. | K+、NH4+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3和O2反应 | B. | NH3和HNO3反应 | C. | NO和O2反应 | D. | NH3和水反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com