
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 102 | 74 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| B. | X和Y的金属性X<Y | |
| C. | 气态氰化物的稳定性H2Z<H2W | |
| D. | ZW3通常用单质Z与单质W反应制备 |
分析 Z、W均由-2价,二者处于ⅥA族,Z有+6价,且原子半径较大,故Z为S元素、W为O元素;X化合价为+2价,处于ⅡA族,Y的化合价为+3价,处于ⅢA族,且原子半径X>Y>硫,故X为Mg、Y为Al,据此对各选项进行判断.
解答 解:Z、W均由-2价,处于ⅥA族,Z有+6价,且原子半径较大,故Z为S元素、W为O元素;X化合价为+2价,处于ⅡA族,Y的化合价为+3价,处于ⅢA族,且原子半径X>Y>硫,故X为Mg、Y为Al,
A.Y的最高价氧化物对应的水化物为氢氧化铝,氢氧化铝不能溶于稀氨水,故A错误;
B.同周期自左而右金属性减弱,故金属性Mg>Al,故B错误;
C.非金属性O>S,故氢化物稳定性H2S<H2O,故C正确;
D.一定条件下,硫与氧气反应生成SO2,不会生成三氧化硫,故D错误;
故选C.
点评 本题考查元素位置结构和性质的关系及应用,题目难度中等,从原子半径和元素的化合价寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键.


科目:高中化学 来源: 题型:填空题
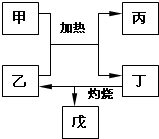 有关元素X、Y、Z、D、E的信息如表
有关元素X、Y、Z、D、E的信息如表| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子立体构型 |
| A | SO2 | sp | 直线形 | 直线形 |
| B | HCHO | sp2 | 平面三角形 | 三角锥形 |
| C | NF3 | sp2 | 四面体形 | 平面三角形 |
| D | NH4+ | sp2 | 正四面体形 | 正四面体形 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A | B | C | D |
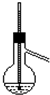 | 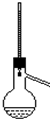 | 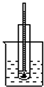 | 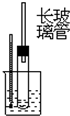 |
| A. | 酒精和浓硫酸混合加热制乙烯 | B. | 石油分馏实验 | ||
| C. | 苯跟溴的取代反应 | D. | 电石跟水反应制乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HAt很稳定 | B. | At是有色固体 | ||
| C. | At易溶于有机溶剂 | D. | AgAt不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL | 0 | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 碳棒为正极 | |
| B. | 碳棒上的电极反应式为2H2O+O2+4e-═4OH- | |
| C. | 铁片上的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 铁片为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
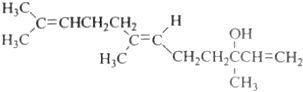
| A. | 橙花醇的分子式C15H26O | |
| B. | 橙花醇在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 橙花醇既能发生取代反应,也能发生加成反应和氧化反应 | |
| D. | 1mol 橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com