
科目:高中化学 来源:2016-2017学年河南省高一上期中化学卷(解析版) 题型:实验题
实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热。下图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)上述反应中_________是氧化剂,_________是还原剂,若反应中氧化产物比还原产物多1mol,则转移的电子数目为__________。
(2)装置B的作用是_____________,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:_________________。
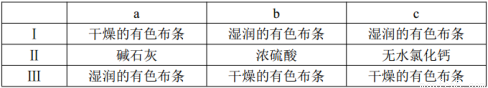
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入________(选“a”“b”或“c”)。
(4)设计装置D、E的目的是为了比较Cl2、Br2、I2的氧化性强弱。已知Br2的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶苯,且I2的苯溶液为紫红色。当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2,请写出D中对应的离子方程式并用双线桥法表示出电子转移情况:________________。打开活塞,将D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色。该现象___________(填“能”或“不能”)说明Br2的氧化性大于I2。
(5)装置F的作用是除去污染性的物质(Cl2、Br2等),已知Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且c(Cl-)/c(ClO-)的值与温度高低有关。若烧杯中装有500mL0.2mol/L的NaOH溶液,则最多可吸收标况下的Cl2的体积为____________L(忽略Cl2溶于水)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上期中化学卷(解析版) 题型:选择题
下列是某校实验小组设计的一套原电池装置,下列有关描述不正确的是( )
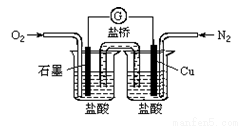
A.此装置能将化学能转变为电能
B. 石墨电极的反应式:O2+2H2O+4e—=4OH—
石墨电极的反应式:O2+2H2O+4e—=4OH—
C.电子由Cu电极经导线流向石墨电极
D.电池总的反应是:2Cu+O2+4HCl=2CuCl2+2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上期中化学卷(解析版) 题型:选择题
下列反应属于取代反应的是( )
A.CH4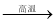 C+2H2
C+2H2
B.C2H6+Cl2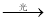 C2H5Cl+HCl
C2H5Cl+HCl
C.CH4+2O2 CO2+2H2O
CO2+2H2O
D.2HI+Cl2=2HCl+I2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上期中化学卷(解析版) 题型:实验题
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:
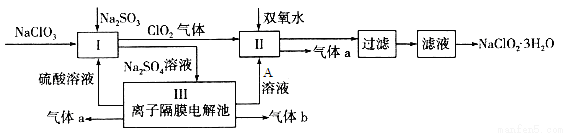
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-36;Ksp(PbS)=8×10-28
③Ⅲ装置中电解硫酸钠溶液,阳极区生成氧气同时产生硫酸,阴极区生成氢气同时产生氢氧化钠。
(1) I中发生反应的离子方程式为 ____________。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | H2CO3 | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为 (用化学式表示);
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上期中化学卷(解析版) 题型:选择题
在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )

A.图中a点对应的是AgBr的不饱和溶液
B.在t °C时,AgBr的Ksp为 4.9×10-13
C.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
D.在t °C时,AgCl(s)+Br-(aq) AgBr(s)+C1- (aq)的平衡常数K≈816
AgBr(s)+C1- (aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江中学高二上期中文化学卷(解析版) 题型:填空题
(1)某离子反应的反应物和产物如下:MnO4﹣+I﹣+H+→Mn2++I2+IO3﹣+H2O。该反应中被还原的元素是 ,氧 化产物是 。
化产物是 。
(2)如果胃酸过多,可服用 (填写下列所提供物质的序号)缓解症状,但如果患有胃溃疡,则不能服用 ,以防止胃穿孔。
①NaOH ②NaHCO3 ③硫酸 ④氨水  ⑤Al(OH)3
⑤Al(OH)3
(3)1L 0.1mol / L 的K2SO4溶液中K+ 的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江中学高二上期中理化学卷(解析版) 题型:选择题
下列判断正确的是( )
A. pH=6的溶液一定呈酸性
B. c(H+)水电离产生 = c(OH-)水电离产生的溶液一定呈中性
C. 使石蕊试液显红色的溶液一定呈酸性
D. 强酸和强碱等物质的量混合后溶液一定呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com