
| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | X表示HA,Y表示OH,Z表示H+ | D. | 该混合溶液中:c(A-)+c(Y)=c(Na+) |
分析 一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2O?HA+OH-,NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒为:c(Na+)=c(A-)+c(HA).
解答 解:一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2O?HA+OH-,NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒得到:c(Na+)=c(A-)+c(HA).
A.一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,二者恰好反应:HA+NaOH=NaA+H2O,所得溶液为NaA溶液,溶液中中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2O?HA+OH-,NaA水解,HA为弱酸,故A错误;
B.c(Na+)>c(A-),说明NaA水解,A-+H2O?HA+OH-,该混合液pH>7,故B错误;
C.HA是弱电解质,则有c(A-)>c(OH-),c(OH-)除了水解产生的还有水电离的,因此c(OH-)>c(HA),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,故C错误;
D.溶液中存在物料守恒c(Na+)=c(A-)+c(HA),Y表示HA,得到c(A-)+c(Y)=c(Na+),故D正确;
故选D.
点评 本题考查了酸碱混合溶液定性判断,题目你知道,根据酸的强弱结合物料守恒、电荷守恒分析解答,考查离子浓度大小比较、溶液pH值、盐类水解等,判断一元酸HA是弱酸为解题关键.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
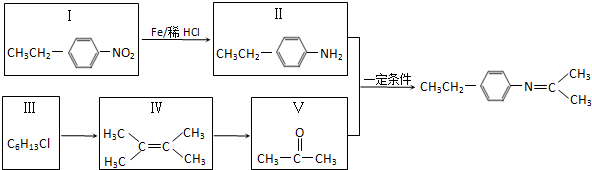
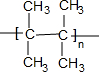 .
.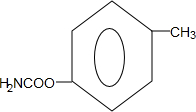 (写出一种).
(写出一种).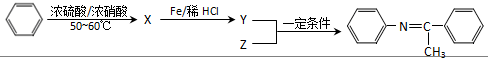
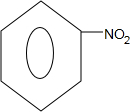 ,Z的结构简式为
,Z的结构简式为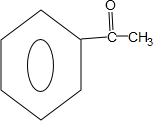 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | Y | ||
| Z | W |
| A. | 原子半径由小到大的顺序为X<Z<Y<W | |
| B. | Y元素最高价氧化物对应的水化物化学式为HYO3 | |
| C. | X、Z两种元素的氧化物中所含化学键类型相同 | |
| D. | Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
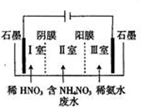 硝酸铵钙[5Ca(NO3)2•NH4NO3•10H2O]极易溶于水,是一种绿色复合肥料.
硝酸铵钙[5Ca(NO3)2•NH4NO3•10H2O]极易溶于水,是一种绿色复合肥料.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
| Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有溶质析出 | B. | 溶液中Ca2+的数目不变 | ||
| C. | 溶剂的质量减小 | D. | 溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通式相同的两种有机物按不同比例混合时,只要总质量一定,完全燃烧的耗氧量就一定 | |
| B. | 除去甲烷中的乙烯可用溴水或酸性高锰酸钾溶液 | |
| C. | 糖类、油脂、蛋白质都会在一定条件下水解 | |
| D. | 戊烷有3种同分异构体,而一氯戊烷有8种同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com