
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
(2)依据定容的正确操作解答;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)质量分数为98%、密度为1.84g•cm-3 的浓硫酸,物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L;配制500mL 1mol•L硫酸溶液,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:500mL×1mol/L=18.4mol/L×V,解得V=27.2mL;
故答案为:18.4;27.2;
(2)定容的正确操作为:洗涤后,向容量瓶中加入蒸馏水到距刻线1-2cm处改用胶头滴管 加水使溶液的凹液面正好与刻线相平;
故答案为:1-2cm;胶头滴管;
(3)①用以稀释硫酸的烧杯未洗涤,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
故答案为:偏低;
②未经冷却趁热将溶液注入容量瓶,冷却后溶液体积偏小,溶液浓度偏高;
故答案为:偏高;
③容量瓶中原有少量的蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变;
故答案为:无影响;
④定容时观察液面俯视,导致溶液体积偏小,溶液浓度偏高;
故答案为:偏高.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作步骤是解题关键,注意误差分析的方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
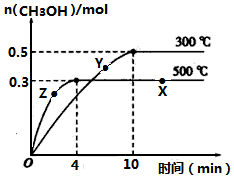 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:4:4 | B. | 1:1:1 | C. | 5:5:4 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ZnCl2 | B. | NaCl | C. | AlCl3 | D. | KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝 | |
| B. | 向氢氧化镁悬浊液中加入浓的NH4Cl溶液,因发生化学反应而溶解 | |
| C. | 足量的Cu与含2molH2SO4的浓硫酸充分反应可生成NA个SO2分子 | |
| D. | 氢氧化铝溶于强碱溶液,说明铝具有一定的非金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn2+HCl=ZnCl2+H2↑ | |
| B. | Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O | |
| C. | HCl+AgNO3=AgCl↓+HNO3 | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com