
| A. | 甲烷与氯气发生取代反应 | |
| B. | 丙烯与水在催化剂的作用下发生加成反应 | |
| C. | 异戊二烯[CH2═C(CH3)-CH═CH2]与等物质的量的Br2发生加成反应 | |
| D. | 2-氯丁烷(CH3CH2CHClCH3)与NaOH乙醇溶液共热 |
分析 A、甲烷与氯气发生取代反应可以生成一氯甲烷、二氯甲烷、三氯甲烷、三氯甲烷,含有的氯原子数目不同,不存在同分异构体;
B、丙烯不是对称结构,与水发生加成反应,羟基(-OH)有2种位置连接;
C、根据二烯烃与溴可发生1,2-加成或1,4-加成来判断;
D、2-氯丁烷(CH3CH2CHClCH3)与NaOH乙醇溶液共热发生消去反应可生成1-丁烯和2-丁烯.
解答 解:A、甲烷与氯气发生取代反应可以生成一氯甲烷、二氯甲烷、三氯甲烷、三氯甲烷,含有的氯原子数目不同,不存在同分异构体,故A正确;
B、丙烯不是对称结构,与水发生加成反应,羟基有2种位置连接,可以生成OHCH2CH2CH3、CH3CHOHCH3,存在同分异构体,故B错误;
C、异戊二烯与溴可发生1,2-加成或1,4-加成两种物质,则存在同分异构体,故C错误;
D、2-氯丁烷(CH3CH2CHClCH3)与NaOH乙醇溶液共热发生消去反应可生成1-丁烯和2-丁烯,则存在同分异构体,故D错误;
故选A.
点评 本题考查有机物的性质,依次来判断产物是否存在同分异构体,做此类题目要注意根据有机物的结构特点分析可能的产物,本题难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H2在正极发生氧化反应 | |
| B. | 燃料电池属二次电池 | |
| C. | 燃料电池的能量转化率常达100% | |
| D. | 供电时产生无污染的水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| B. | 硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═CO2↑+2H2O | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是将太阳能转化为电能的常用材料 | |
| B. | 用加热的方法杀死H7N9禽流感病毒是采用了蛋白质变性原理 | |
| C. | “克隆羊”的关键技术之一是找到一些激活普通细胞的酶,并将它浸泡在酒精中保存 | |
| D. | 钠钾合金在常温下呈液态,可用于快中子反应堆作热交换剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
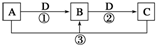 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5NA | |
| B. | 1 mol Na2O2与足量的水反应,转移的电子数为2NA | |
| C. | NA 个SO3分子在标准状况下的体积为22.4 L | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷(己烯):加入溴水,分液 | B. | 硝酸钾(氯化钠):浓溶液降温结晶 | ||
| C. | Fe3+(Al3+)):过量的氨水,过滤 | D. | CO2(CO):点燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收546.6 kJ热量 | |
| B. | 1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于546.6 kJ | |
| C. | 相同条件下,1 mol氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 | |
| D. | 2 mol H-F键的键能比1 mol H-H键和1 mol F-F 键的键能之和大546.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X有多种气态氢化物 | B. | 原子半径:R>W | ||
| C. | 气态氢化物的热稳定性:R>Y | D. | 最高价氧化物的水化物的酸性:X>R |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com