
| A.由水电离产生的c(H+)=1×10-2mol?L-1溶液中,可能存在:CO32-、NH4+、Cl-,Na+ |
| B.某醋酸稀溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| C.Ba(OH)2溶液中加人过量的Al2(SO4)3溶液,其离子方程式为:3Ba2++60H-+2Al3++3SO42-=3BaS04↓+2Al(0H)3↓ |
| D.物质的量浓度均为1mol?L-1的NaCl和MgCl2混合液中,含有Cl-的数目为3NA(NA表示阿伏加德罗常数的值) |
科目:高中化学 来源:不详 题型:单选题
| A.Na+、HCO3-、CO32-、Cl- | B.K+、S2-、SO32-、SO42- |
| C.Cu2+、Na+、Cl-、NO3- | D.Fe3+、K+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.常温下,在PH=1的溶液:Cu2+、Na+、Mg2+、NO3- |
| B.常温下,在滴加酚酞试液显红色的溶液:K+、HCO3-、Br-、Ba2+ |
| C.常温下,在PH<7的溶液中,Fe3+、Cu2+、Cl-、NO3- |
| D.常温下,在含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+、S2-、K+、NO3- | B.NH4+、NO3-、Al3+、K+ |
| C.MnO4-、K+、CO32-、Na+ | D.K+、SO42-、HCO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4+、Fe3+、SO42-、Cl- | B.CO32-、PO43-、K+、Na+ |
| C.Na+、SO42-、NO3-、Cl- | D.HPO42-、Na+、HSO3-、K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
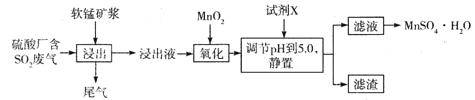

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
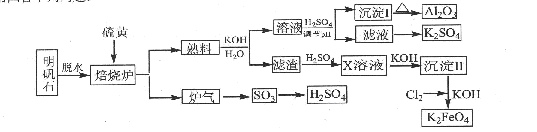
 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
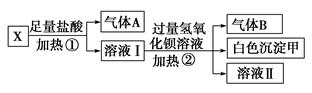
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.误将洁厕灵与“84”消毒液混合:2H++Cl-+ClO-=Cl2↑+H2O |
| B.玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O |
| C.氯化铁溶液腐蚀印刷线路铜板:Fe3++Cu=Fe2++Cu2+ |
| D.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com