
【题目】有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为 ,下列说法不正确的是( )
,下列说法不正确的是( )
A. X的化学式为C8H8
B. 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C. X能使高锰酸钾酸性溶液褪色
D. X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
科目:高中化学 来源: 题型:
【题目】下列关于容量瓶的使用操作中正确的是( )
A.使用容量瓶前应先检查它是否漏水
B.容量瓶先用蒸馏水洗净,再用待配液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到液面距刻度线1~2 cm处,再改用胶头滴管滴加蒸馏水至刻度线
D.浓硫酸稀释后马上转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能使品红溶液褪色,且褪色原理基本相同的是( )
①活性炭
②氯水
③二氧化硫
④臭氧
⑤过氧化钠
⑥双氧水.
A.①②④
B.②③⑤
C.②④⑤⑥
D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2>Fe3+> SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
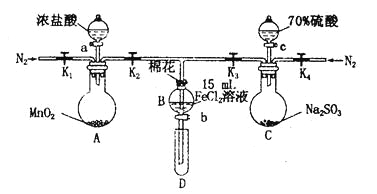
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
V.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程I的目的是____。
(2)检验B中溶液是否还有Fe2+的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀.写出该反应的离子方程式____ 。
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式____。
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定不能够证明氧化性Cl2>Fe3+>SO2的是____(填“甲”、“乙”或“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中 含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(6)将B中的FeCl2溶液换成100 mLFeBr2溶液并向其中通入1.12 LCl2(标准状况下),若溶液中有1/2的Br一被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为____ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化钠是重要的化工原料,请回答下列问题:
(一)用氢氧化钠溶液制备NaClO、NaClO3等
(1)NaOH中所含化学键类型为______________。NaClO3的化学名称为_____________。
(2)已知:Cl2(g)+2NaOH(aq)=NaCl(aq)+ NaClO(aq)+H2O(l) △H1= -102 kJ·mol-1
3Cl2(g)+6NaOH(aq)=5NaCl(aq)+ NaClO3(aq)+3H2O(l) △H2= -422 kJ·mol-1
写出在溶液中NaClO分解生成 NaClO3的热化学方程式___________________________。
(二)用氢氧化钠溶液处理天然气中少量的羰基硫(COS)及利用的过程如下(部分产物已略去):![]() .
.
(3)羰基硫与CO2结构相似,则羰基硫分子的电子式为_______________。
(4)反应I除生成两种正盐外,还有水生成,其化学方程式为__________________。
(5)已知X溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g) ![]() 2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是( )
2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③混合气体的总压强不再改变的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
A. ①④ B. ②③⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载,“银针验毒”涉及的化学反应是 4Ag + 2H2S + O2 → 2X + 2H2O,下列说法正确的是( )
A.X的化学式为AgS
B.银针验毒时,空气中氧气失去电子
C.反应中Ag和H2S均是还原剂
D.每生成1mo1X,反应转移2mo1 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别为0.6mol和0.5mol的A、B两种气体,充入0.4L密闭容器中发生反应:3A(g)+B(g) ![]() mC(g)+2D(g),经5min达到平衡,此时C为0.2mol。又知在此反应时间内D的平均反应速率为0.1mol·L-1·min-1,回答下列问题:
mC(g)+2D(g),经5min达到平衡,此时C为0.2mol。又知在此反应时间内D的平均反应速率为0.1mol·L-1·min-1,回答下列问题:
(1)m值为__________________;
(2)B的转化率为_______________________;
(3)平衡时容器内物质的总物质的量为________________________;
(4)在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是______
①v(A)=0.5 mol·L-1·min-1 ② v(B)=0.2 mol·L-1·min-1
③ v(C)=0.3 mol·L-1·min-1 ④ v(D)=0.1 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com