

| A. | 甲中盛硫酸锌溶液,乙中盛硫酸铜溶液,锌为阴极 | |
| B. | 乙中盛硫酸铜溶液,铜离子在铜电极上被氧化 | |
| C. | 电池工作时,盐桥中的阳离子移向甲,阴离子移向乙,溶液仍保持电中性 | |
| D. | 取出盐桥,电流表指针即回到零点 |
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
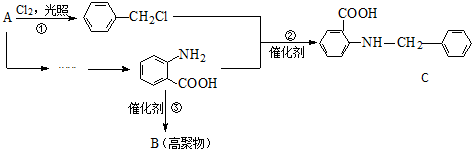
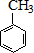 $→_{水浴加热}^{浓H_{2}SO_{4}/浓HNO_{3}}$
$→_{水浴加热}^{浓H_{2}SO_{4}/浓HNO_{3}}$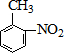
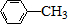 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$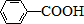
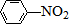 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$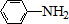 (弱碱性,易被氧化)
(弱碱性,易被氧化) .
.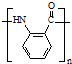 .
.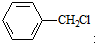 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,X有3种结构.
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,X有3种结构.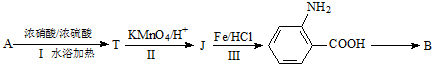
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向浓度均为0.1 mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)>Ksp(AgI) | |
| B. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 | |
| C. | 用激光笔分别照射蛋清溶液和葡萄糖溶液,能产生光亮“通路”的是蛋清溶液 | |
| D. | 用铂丝蘸取某溶液进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色,该溶液一定是钾盐溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.
;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )+N2O4→N2↑+CO2↑+H2O(未配平).下列说法错误的是( )
)+N2O4→N2↑+CO2↑+H2O(未配平).下列说法错误的是( )| A. | C2H8N2分子中既含有极性键,也含有非极性键 | |
| B. | 火箭发射前要低温加注液态氧化剂N2O4,N2O4泄漏后可产生红棕色气体 | |
| C. | 氧化产物与还原产物的物质的量之比为2:3 | |
| D. | 该反应每消耗1mo N2O4时转移8 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取某溶液置于酒精灯火焰上灼烧,直接观察火焰颜色,检验K+的存在 | |
| B. | 用玻璃棒蘸取Na2CO3溶液,滴在湿润的pH试纸上,测定该溶液的pH | |
| C. | 浓硫酸不慎沾到皮肤上,立即用大量的NaOH溶液冲洗 | |
| D. | 试管可用酒精灯直接加热,也可用水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1mol奎尼酸与足量钠反应生成56L氢气 | |
| B. | 奎尼酸能使溴的四氯化碳溶液褪色 | |
| C. | 与乙醇、乙酸均能发生取代反应 | |
| D. | 不能用碳酸氢钠溶液鉴别奎尼酸和苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com