
 25℃时在10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )| A. | 当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol/L | |
| B. | HCl溶液滴加一半时,溶液pH>7 | |
| C. | 0.1mol/LNa2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) | |
| D. | 在M点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
分析 A、n(HCO3-)=0.001mol时,溶液的pH=8,所以加入0.1mol/LHCl溶液10mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠;
B、HCl溶液滴加一半时,也就是10mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠,其中碳酸氢钠水解溶液呈碱性;
C、根据溶液的电荷守恒判断;
D、在M点:n(CO32-)=n(HCO3-)=0.0005时,得到等物质的量碳酸钠和碳酸氢钠两者水解溶液呈碱;
解答 解:A、n(HCO3-)=0.0001mol时,溶液的pH=8,所以加入0.1mol/LHCl溶液10mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠,所以溶液中NaHCO3的物质的量浓度为0.05mol/L,故A错误;
B、HCl溶液滴加一半时,也就是10mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠,其中碳酸氢钠水解溶液呈碱性,所以溶液的pH>7,故B正确;
C、Na2CO3溶液中存在电荷守恒,为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故C正确;
D、在M点:n(CO32-)=n(HCO3-)=0.0005时,得到等物质的量碳酸钠和碳酸氢钠两者水解溶液呈碱,所以离子浓度大小为:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+),故D正确;
故选A.
点评 本题考查了离子浓度大小的比较,为高频考点,侧重于学生的分析能力的考查,注意根据物料守恒、电荷守恒来分析解答,难点是B,注意把握图象曲线的变化特点,难度中等.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:选择题
| 序号 | 相关实验 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO3 | 稀硫酸、澄清的石灰水 | 产生使澄清石灰水变浑浊的无色无味气体的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 鉴别葡萄糖和蔗糖 | 银氨溶液 | 有银镜产生的是葡萄糖 |
| ④ | 鉴别AlCl3和MgCl2溶液 | 氨水 | 先产生白色沉淀,然后沉淀消失的是AlCl3溶液 |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和浓溴水用铁作催化剂制溴苯 | |
| B. | 氯乙烷与NaOH溶液共热,在水解后的溶液中直接加入AgNO3溶液检验Cl- | |
| C. | CH4与Cl2在光照条件下制备纯净的CH3Cl | |
| D. | 乙烯通入Br2的CCl4溶液中制备CH2Br-CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应① | 反应② |
| A | NaOH与HCl反应 | Mg(OH)2与HNO3反应 |
| B | 向BaCl2溶液中滴加稀H2SO4 | 向Ba(OH)2溶液中滴加CuSO4溶液 |
| C | Cl2通入NaOH溶液中 | Cl2通入澄清石灰水中 |
| D | Fe与HCl反应 | Fe与CH3COOH反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
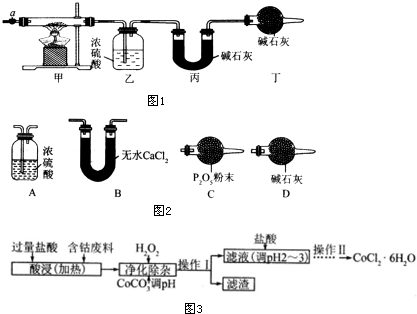
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 强氧化性物质可以用来杀菌消毒 | ClO2可用于自来水消毒 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硫酸,浓硫酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 较强的酸可以制取较弱的酸 | 硫化氢通入硫酸铜溶液中不能反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com