
| A. | 1molH2和1mol I2完全反应放出4.5kJ热量 | |
| B. | 1个氢分子和1个碘分子完全反应放出9kJ热量 | |
| C. | 1molH2和1mol I2完全反应生成气态HI放出9kJ热量 | |
| D. | 0.5mol H2和0.5mol I2完全反应需要吸收4.5kJ热量 |
分析 热化学方程式$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)═HI(g)△H=-4.5kJ•mol-1的意义是$\frac{1}{2}$molH2和$\frac{1}{2}$mol I2完全反应生成气态HI放出4.5kJ热量,化学计量数只代表物质的量,物质的量与能量呈正比.
解答 解:A.热化学方程式$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)═HI(g)△H=-4.5kJ•mol-1的意义是$\frac{1}{2}$molH2和$\frac{1}{2}$mol I2完全反应生成气态HI放出4.5kJ热量,故A错误;
B.化学计量数只代表物质的量,不表示分子个数,故B错误;
C.热化学方程式$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)═HI(g)△H=-4.5kJ•mol-1的意义是$\frac{1}{2}$molH2和$\frac{1}{2}$mol I2完全反应生成气态HI放出4.5kJ热量,则1molH2和1mol I2完全反应生成气态HI放出9kJ热量,故C正确;
D.0.5mol H2和0.5mol I2完全反应需要放出4.5kJ热量,不是吸收,故D错误;
故选C.
点评 本题是常识性知识的考查,难度不大.主要是考查学生对热化学方程式含义以及表示的了解掌握情况,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣和学习积极性.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:多选题
| A. | 上述两个反应都是置换反应 | |
| B. | 反应①中若有1mol Br2生成,则转移电子的物质的量为2mol | |
| C. | 氧化性由强到弱顺序为:KClO3>Cl2>Br2 | |
| D. | 反应②中还原剂与氧化剂的物质的量之比为6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
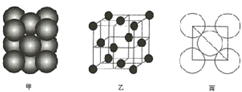 A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,C原子最外层电子数是其电子总数的$\frac{1}{3}$;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第10列.
A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,C原子最外层电子数是其电子总数的$\frac{1}{3}$;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第10列.
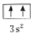 违背了泡利原理.
违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸、氯化铁溶液均为胶体 | B. | 水玻璃、明矾溶液均为混合物 | ||
| C. | 硫酸、纯碱、NaCl分别属于酸、碱、盐 | D. | KCl和Cu均属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 每100g含有 营养成分 | 糖类 | 油脂 | 蛋白质 | 维生素C | 钙 | 镁 | 钠 | 锌 | 苯甲酸钠 |
| 7.6g | 7.8g | 7.4g | 18mg | 201mg | 18.2mg | 30.8mg | 8.1mg | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
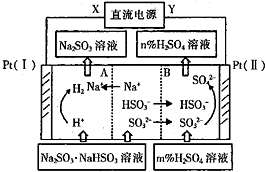
| A. | Pt(Ⅱ)为阳极 | B. | 阳极区[H+]增大 | ||
| C. | 图中的n<m | D. | 阴极电极反应式为2H++2e-═H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com