
| A. | 标准状况下,3.36 L NO2与水充分反应转移的电子数为0.1NA | |
| B. | 12 g金刚石中含有的共价键数为4NA | |
| C. | 将22.4 L Cl2通入足量水中,反应转移的电子数为NA | |
| D. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA |
分析 A、二氧化氮与水的反应为歧化反应;
B、求出金刚石的物质的量,然后根据均摊法来计算;
C、氯气的状态不明确;
D、ClO-是弱酸根,在溶液中会水解.
解答 解:A、标况下,3.36L二氧化氮的物质的量为0.15mol,而二氧化氮与水的反应为歧化反应,3mol二氧化氮转移2mol电子,故0.15mol二氧化氮注意0.1mol电子即0.1NA个,故A正确;
B、12g金刚石是1mol碳.金刚石的结构是按四面体成键的,一个碳上连着四个共价键,但是一个共价键是两个碳共用的,所以说共价键数为2NA,故B错误;
C、氯气的状态不明确,故其物质的量不能计算,则转移的电子数不能计算,故C错误;
D、ClO-是弱酸根,在溶液中会水解,故溶液中ClO-的个数小于NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大


科目:高中化学 来源: 题型:填空题
 ′
′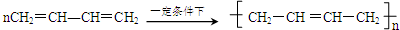 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是SiO2 | |
| B. | 利用SiO2与碳反应制粗硅 | |
| C. | 常温下硅性质稳定,不与氯气、强酸、强碱溶液等起反应 | |
| D. | SiO2性质稳定,常温下不与任何物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从Li+到Cs+的氧化性依次增强 | |
| B. | 从Li到Cs的氢氧化物的碱性越来越强 | |
| C. | 从Li到Cs的熔点依次升高 | |
| D. | 原子半径最大的是铯,而金属性最强的是锂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNa与足量O2反应,转移0.2nA个电子 | |
| B. | 1L0.1mol•L-1Na2S溶液中含有0.1nA个S2- | |
| C. | 常温下,44gCO2含有nA个C原子 | |
| D. | 标准状况下,22.4L的CCl4含有4nA个Cl原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com