
电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液。由该废液回收铜并得到净水剂(FeCl36H2O)的步骤如下:
(2)I中加入过量Fe粉 ,然后过滤,滤渣中有Cu、Fe,为了得到纯净铜,不产生新的杂质,试剂A应是HCl。.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,通入足量氯气;
IV.……,得到FeCl36H2O晶体。
(1)用FeCl3溶液腐蚀铜箔的离子方程式是 。
(2)试剂A是 。
(3)取少量步骤III所得的溶液于试管中,能够证明通入氯气足量的是 。
a.检验Cl2的存在 b检验Fe3+的存在 c.检验Fe2+的不存在
(4)完成步骤IV需要用到的实验装置是 (填字母)。
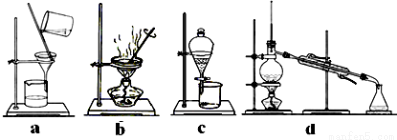
(1)2Fe3+ + Cu =2Fe2+ + Cu2+ (2)盐酸 (3)ac (4)ab
【解析】
试题分析:(1)Fe3+的氧化性强于Cu2+的,根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,2Fe3++Cu=Cu2++2Fe2+;(2)I中加入过量Fe粉 ,滤渣中有Cu、Fe,为了得到纯净铜,不产生新的杂质,试剂A应是盐酸;(3)证明氯气过量,验证溶液中有氯气的存在,可以用红色布条;因为氯气过量,Fe2+全部转化成了Fe3+,可以验证Fe2+的是否存在,因此ac正确;(4)从溶液中得到晶体,一般采用蒸发操作法,b正确,当有晶体析出时停止加热,让余温蒸发剩下的水,得到固液共存的状态,再采用过滤法,因此ab正确。
考点:考查铁及其化合物、实验基本操作等相关知识。


科目:高中化学 来源:2014-2015福建省龙岩市非一级达标校高一上学期期末化学试卷(解析版) 题型:填空题
(10分)某无色透明溶液中只可能大量存在OH-、Cl-、Na+、Mg2+、Cu2+中的几种离子。
(1)溶液显无色,说明原溶液中不存在的离子是_______;
(2)取少量原溶液加入铝粉有气体放出,说明原溶液中肯定存在的离子是___________;该反应除产生气体外,另一种生成物的化学式是_________________;
(3)另取少量原溶液加入过量稀硝酸,再加几滴AgNO3溶液,出现白色沉淀。
该过程中发生2个反应,对应的离子方程式是 、 。
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市丰台区高一上学期期末考试化学试卷(解析版) 题型:填空题
A~G是中学化学常见物质,其中A为相同条件下密度最小的气体单质,E为红棕色气体。


(1)G的化学式是 。
(2)A和B反应生成C的化学方程式为 。
(3)检验C可选用的试剂是 (填字母)。
a.湿润的蓝色石蕊试纸 b.湿润的红色石蕊试纸 c.浓盐酸
(4)将盛满气体E的大试管倒扣在盛水的水槽中,发生反应的化学方程式为 ,现象为 。
(5)汽车尾气中含有CO和物质D,一种治理方法是在汽车排气管上装一个催化转化装置,使CO和D反应,生成另外两种无毒气体。该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市丰台区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是
①Al ②Al2O3 ③Ca(OH)2 ④Al(OH)3 ⑤Na2CO3 ⑥NaHCO3
A.①②⑤⑥ B.①②③⑤ C.①②④⑥ D.②③④⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市丰台区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列试剂中,标签上应标注  和
和  的是
的是
A.Na B.HNO3 C.NaOH D.HCl
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:选择题
要证明CuSO4溶液显蓝色不是由于SO42-造成的,下列实验无意义的是
A.观察K2SO4溶液的颜色
B.加水稀释CuSO4溶液,溶液颜色变浅
C.向CuSO4溶液中滴加过量NaOH溶液,振荡后静置,溶液变成无色
D.向CuSO4溶液中滴加过量Ba(NO3)2溶液,振荡后静置,溶液未变成无色
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:选择题
检验氯化氢气体中是否混有氯气,不可采用的方法是
A.用湿润的有色布条 B.用湿润的蓝色石蕊试纸
C.将气体通入硝酸银溶液 D.用湿润的淀粉碘化钾试纸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:选择题
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法错误的是
已知: ①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)

A.碳棒上发生的电极反应:4OH—- 4e—= O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:填空题
氢是宇宙中最丰富的元素,为一切元素之源。
23.1.H原子的电子排布式是“1s1”,该式子未表明电子运动状态的方面是 (选填编号)。
a.电子层 b.电子亚层
c.电子云的伸展方向 d.电子的自旋
24.2.金属锂与氢气在一定条件下能直接化合生成 LiH,以下事实能说明LiH是离子化合物的是 (选填编号)。
a.H为-1价 b.熔融状态能导电 c.加热到600℃不分解
LiH的电子式为 。
核外有2个电子的简单阴、阳离子有若干种,试比较它们半径的大小 。
25.3.非金属元素R的气态氢化物的化学式为H8-nR,则R的最高氧化物的化学式为 。
26.4.根据下表中的键能数据,写出氮气、氢气合成氨气的热化学方程式 。
在合成氨的工业生产中,科学家在努力寻找活性温度更低的新催化剂,简述其意义 。
共价键 | 键能(KJ/ mol) |
N≡N | 946 |
H-H | 436 |
H-N | 391 |
27.5.钯(Pd)是优良的储氢金属:2Pd (s)+xH2(g) 2PdHx (s) +Q(Q>0)
2PdHx (s) +Q(Q>0)
通常状况下,x的最大值为0.8,为使x>0.8可采取的措施是 ;为使PdHx 产生H原子并在固体中快速流动,可采取的措施是 (选填编号)。
a.升温 b.减压 c.及时移走金属钯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com