
科目:高中化学 来源:不详 题型:单选题
A.NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=1︰1时,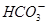 完全转化为CaCO3 完全转化为CaCO3 |
| B.CO2通入石灰水中,当n(CO2)︰n[Ca(OH)2]=1︰1时,能得到澄清溶液 |
C.AlCl3溶液与烧碱溶液反应,当n(OH-)︰n(Al3+)=1︰1时,铝元素以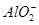 形式存在 形式存在 |
| D.Fe与稀硝酸反应,当n(Fe)︰n(HNO3)=1︰1时,溶液中铁元素只以Fe3+形式存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
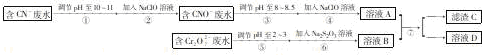
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuSO4溶液呈天蓝色是因为含有[Cu(H2O)4]2+ |
| B.魔术表演中常用一种含硫氰化铁配离子的溶液来代替血液 |
| C.[Ag(NH3)2]+是化学镀银的有效成分 |
| D.除去硝酸银溶液中的Ag+,可向其中逐滴加入氨水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
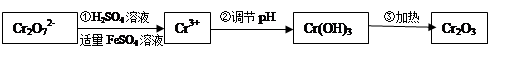
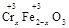 ·y
·y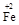 O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(
O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(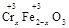 ·y
·y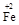 O)化学式是 。
O)化学式是 。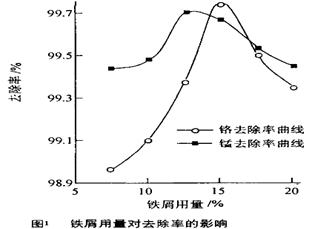
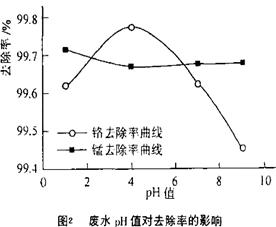
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu2+、C1—、Na+ | B.H+、Cl—、CO32— |
| C.Ba2+、Na+、SO42— | D.H+、K+、OH— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com