
 .
.
分析 (1)设此烃的分子式为CxHy,求出x和y即可;
(2)取代反应中Br取代H原子的位置,即相对分子质量变化为80-1=79,据此解答即可;
(3)依据烷烃消去反应生成烯烃解决即可;
(4)能与NaHCO3反应生成CO2,含有羧基,据此解答即可;
(5)R在氧气中完全燃烧后,只生成等物质的量的CO2和H2O,有机物中C:H=1:2,据此解答即可.
解答 解:(1)设此烃的分子式为CxHy,含氢的质量分数为16.67%,即$\frac{y}{72}$×100%=16.67%,解y=12,故x=$\frac{72-12}{12}$=5,故此烃的分子式为C5H12,故答案为:C5H12;
(2)取代反应中Br取代H原子的位置,即相对分子质量变化为80-1=79,故一溴代物的相对分子质量为:72+80-1=151,故答案为:151;
(3)正戊烷还原为烯烃,可以是1-戊烯、2-戊烯,异戊烷可以产生3种烯烃,分别为:2-甲基-1-丁烯、2-甲基-2-丁烯和3-甲基-1-丁烯,故此戊烷为2-甲基丁烷,结构简式为:(CH3)2CHCH2CH3,故答案为:(CH3)2CHCH2CH3;
(4)依据题意得出:该有机物分子中有一个羧基,一个羧基的式量是45,该有机物的式量是72,所以剩余式量是27,符合乙烯基的式量,所以该有机物是丙烯酸,结构简式为:CH2=CHCOOH,故答案为:CH2=CHCOOH;
(5)由题意得出C:H=1:2,①当R为单官能团的链状有机物时,设此分子式为:CnH2nOx,依据题意得出:14n+16x=72,讨论得:n=4,x=1符合题意,故此有机物的分子式为:C4H8O,此有机物为单官能团,可以是醛基,故结构简式为:CH3CH2CH2CHO,(CH3)2CHCHO,故答案为:CH3CH2CH2CHO;(CH3)2CHCHO;
②由图得出核磁共振氢谱可以得出此有机物中含有2种环境不同的H,生成等量的二氧化碳和水,故此有机物分子式为:C4H8O,故结构简式为: ,故答案为:
,故答案为: .
.
点评 本题主要考查的是有机物结构简式的确定,充分利用所给的条件进行有机物结构的判断即可,难度较大.


科目:高中化学 来源: 题型:解答题
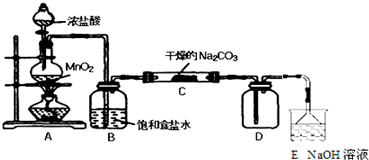
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中, 加入蒸馏水至固体溶解,然后各取1~2mL 所得溶液分别置于甲、乙两支试管中. | 得到无色溶液. |
| 步骤2:向甲试管中加入过量的BaCl2溶液, 静置. | 若溶液变浑浊,证明固体中含有Na2CO3. |
| 步骤3:取甲试管中上层清液少许于另一只 试管中,滴加少量澄清石灰水, 充分振荡. | 若上层清液变浑浊, 证明固体中含有NaHCO3. |
| 步骤4:向乙试管中先加入过量的稀HNO3 稀HNO3;再滴入少量AgNO3溶液溶液. | 若生成白色沉淀;证明固体中含有氯化钠. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH${\;}_{4}^{+}$+D2O?NH3•D2O+H+ | B. | NH${\;}_{4}^{+}$+D2O?NH3•HDO+D+ | ||
| C. | c(OD-)•c(H+)=Kw | D. | c(OH-)•c(D+)=Kw |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z<Y<W,而离子半径:W<Y<Z | |
| B. | W的氯化物水溶液中滴加过量NaZ饱和溶液,可生成W的配合物用于冶金工业 | |
| C. | 由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 | |
| D. | 已知YX3沸点远高于YZ3,则Y-X键的键能高于Y-Z键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.
Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl2溶液中通入,2Fe2++Cl2=2Fe3++2Cl- | |
| B. | FeCl3溶液跟过量氨水,Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ | |
| C. | 碳酸氢钙溶液跟稀硝酸,Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ | |
| D. | 钠与水的反应,2Na+2H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com