
【题目】生活中处处有化学。请根据你所学过的化学知识,判断下列说法中错误的是
A.医疗上常用体积分数为70%~75%的酒精作消毒剂
B.为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒
C.海鲜、肉类等食品用福尔马林浸泡防腐保鲜
D.碘沾在手上立即用酒精洗涤
科目:高中化学 来源: 题型:
【题目】下列表格是元素周期表的一部分,请按要求填空
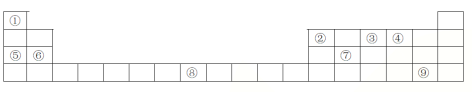
(1)元素①和⑤形成的化合物中存在的化学键类型为__________________
(2)写出由①②④形成的一种一元酸的分子式_________________
(3)写出由③形成的单质的电子式_________________
(4)列举元素⑦形成的氧化物一种用途________________;元素⑧在周期表中的位置 ____,
天津市有着丰富的海水资源,海水中元素⑤、⑥和⑨的含量很丰富,某化学兴趣小组先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。请回答下列问题
回答下列问题:
(5)海水淡化的方法主要是___________________________________(至少列举2种)
(6)采用“空气吹出法”从浓海水中吹出Br2,常温下,Br2的颜色为___________________。
吹出的溴用纯碱溶液吸收,吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+ NaHCO3(未配平),当吸收1mol Br2时,转移的电子数为________mol.
(7)从海水中获得元素⑤或⑥的化合物的一段工艺流程如图:
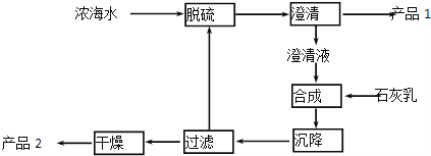
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,产品1的化学式为________________。产品2为Mg(OH)2。常温下向浓海水中滴加NaOH溶液,当Mg2+恰好完全沉淀时溶液的pH为_________。(已知25℃时Ksp[Mg(OH)2]=1.0×10-13)
(8)欲由MgCl2·6H2O加热制备MgCl2时,实验能取得成功的关键操作或条件是_________。
采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)基态亚铜离子价电子排布式为____________;第一电离能I(Cu)________I (Zn)(填“>”或“<”)原因__________________________________________;
(2)Cu(CH3CN)42+比四氨合铜离子还稳定,配离子中Cu的配位数是_______,配体中碳原子的杂化类型是_________________,1molCH3CN中σ键的个数为_____________;
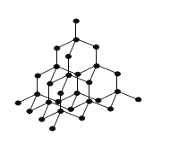
(3)CuCl是有机合成中常见催化剂。CuCl熔化后几乎不导电,推测CuCl晶体中化学键类型为_________;CuCl加强热会分解生成铜,铜晶体的堆积方式为__________(用文字表示)。
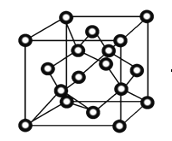
(4)冰晶体的结构与金刚石的结构相似,属立方晶系。如图,将金刚石晶胞中的C原子全部置换成O原子,O原子与最近距离的四个O原子相连,H原子插入两个相连的O原子之间,与氧形成一个共价键和一个氢键,即为冰中的共价键和氢键。0℃时冰晶体中氢键的键长(A—H…B)为_______________pm(列式并计算)。(0℃时冰密度为0.9g˙cm-3)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常用的酸碱指示剂酚酞的结构简式如图所示,下列关于酚酞的说法正确的是( )
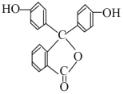
A. 酚酞分子中的所有碳原子在同一平面上 B. 酚酞的分子式为C20H14O4
C. 1mol酞最多与2molNaOH发生反应 D. 酚酞分子与苯酞互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关材料的叙述中,错误的是
A. 合金具有许多优良的物理、化学或机械性能
B. 硅单质是光导纤维的主要成分
C. 硅酸盐产品有陶瓷、玻璃、水泥等
D. 普通玻璃是以纯碱、石灰石和石英为原料制成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从溴乙烷制取1, 2-二溴乙烷,下列转化方案中最好的是
A. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
B. CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
C. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH3
CH2BrCH3![]() CH2BrCH2Br
CH2BrCH2Br
D. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应所对应的方程式正确的是( )
A. Cl2与H2O反应:Cl2+H2O===Cl-+2H++ClO-
B. 向NaNO2溶液中滴加酸性KMnO4溶液:5NO+2MnO+3H2O===5NO+2Mn2++6OH-
C. 向NaHSO4溶液中加入Ba(OH)2溶液至SO![]() 刚好沉淀:H++SO
刚好沉淀:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
D. 向Ba(OH)2溶液中加入硫酸:Ba2++SO![]() ===BaSO4↓
===BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
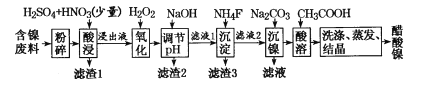
【题目】醋酸镍((CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
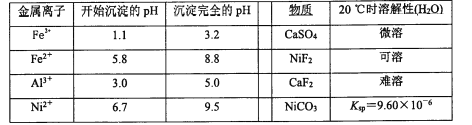
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
(1)粉碎含镍废料的作用__________________________________
(2)酸浸过程中,l molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:___。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:____。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是____。
(5)滤渣3主要成分的化学式是____。
(6)沉镍过程中,若c(Ni2+)= 2.0 mol.L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为____g(保留一位小数)。
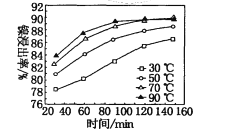
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为____℃、______min。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com