
2- 4 |

2- 3 |
- 3 |
2- 4 |
2- 4 |
- 3 |
2- 3 |
- 3 |
2- 4 |
2- 4 |
2- 4 |
2- 4 |
- 3 |
2- 3 |
- 3 |


科目:高中化学 来源: 题型:
| A、反应前O2的体积为672 mL |
| B、化合物XY2的摩尔质量为76 g?mol-1 |
| C、反应后气体总质量为1.72 g |
| D、XY2的质量为0.78g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠熔成小球并在液面上游动 |
| B、有气体生成 |
| C、溶液底部有银白色固体生成 |
| D、溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| W | 原子电子层数与核外电子数相等 |
| X | 核外L层上s亚层的电子总数为p亚层上的电子总数的一半 |
| Y | 元素的原子半径在短周期中最大(除稀有气体外) |
| Z | 原子核外p亚层上的电子总数比s亚层上的电子总数多2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
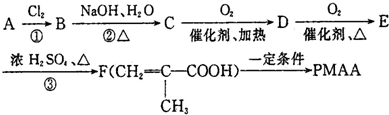
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏操作时,冷凝水的方向应当由下往上 |
| B、分液操作时,首先要打开分液漏斗的上口活塞,或使活塞上的小孔与上口部的小孔对准,然后进行分液 |
| C、提取碘水中的碘单质时,应选择有机萃取剂,如酒精 |
| D、萃取分液后,要得到被萃取的物质,通常还要进行蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com