
常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液(设混合后溶液体积等于混合前两液体体积之和),两者pH都升高了1,则加入水和加入NaOH溶液的体积比约为( )
A.11:1 B.10:1 C.6:1 D.5:1
B.10:1 C.6:1 D.5:1
科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:选择题
一定条件下,反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g) △H =-a kJ·mol-1,在5 L密闭容器中进行,10 s时达到平衡,水蒸气的物质的量增加了0.6 mol,则下列说法正确的是( )
4NO(g)+6H2O(g) △H =-a kJ·mol-1,在5 L密闭容器中进行,10 s时达到平衡,水蒸气的物质的量增加了0.6 mol,则下列说法正确的是( )
A.第10s时,H2O的反应速率为0.012 mol·Lˉ1·sˉ1
B.10s内,NH3的平均反应速率为0.48 mol·Lˉ1·minˉ1
C.10s内,反应放出的热量为a kJ
D.这10s内,O2的反应速率逐渐减小,NO的反应速率逐渐增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
I 已知,CO 的毒性表现在 CO 与血红蛋白(Hb)结合成 Hb·CO,使血红蛋白失去输送 O2 功能。CO 进入血液后有如下平衡:CO+Hb·O2 O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
(1)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以说明:
(2)抽烟时,进入肺部的空气中 c(CO)=10-6mol/L,c(O2 )=10-2mol/L,则 c(Hb·CO)为 c(Hb·O2)的 倍。
(3)已知当血液中c(Hb·CO)/c(Hb·O2)的比值大于 0.02 时,人的智力会很快受到损伤,为避免人的智力受到损伤,c(O2)与 c(CO)的比值应大于___________。
II 在某一温度条件下, Bodensteins 研究了反应:2HI(g)  H2(g) +I2(g),气体混合物中 HI 的物质的量浓度 x(HI)与反应时间 t 的关系如下表:
H2(g) +I2(g),气体混合物中 HI 的物质的量浓度 x(HI)与反应时间 t 的关系如下表:
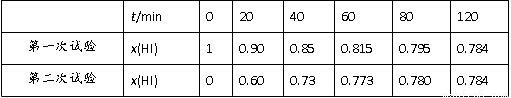
(4)根据上述实验结果,该反应的平衡常数K的计算式为_________。
(5)上述反应,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)×x(I2),其中k正、k逆为速率常数,则k逆为_________(以K和k正表示)。若k正=0.002·min-1,第一次实验时,当t=20min,v正=___________·min-1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
关于中和热的测定实验,下列说法正确的是 ( )
A.为了使反应进行的更完全,可以使酸或碱适当过量
B.为了使反应充分,可以向酸(碱)中分次加入碱(酸)
C.中和热为一定值,实验结果与所用酸(碱)的用量和种类均无关
D.用铜丝代替玻璃棒搅拌,会使中和热测定值偏大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
对 N2+3H2 2NH3 反应,仅改变下列一个条件,就能提高活化分子的浓度从而加快正反应速率的是( )
2NH3 反应,仅改变下列一个条件,就能提高活化分子的浓度从而加快正反应速率的是( )
A.加热 B.增大体积 C.加负催化剂 D.补充 He
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)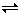 2C(g)。若经2s后测得C的浓度为0.6mol/L,现有几种说法:
2C(g)。若经2s后测得C的浓度为0.6mol/L,现有几种说法:
①用物质A表示的反应的平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s )
③2s时物质A的转化率为70%
④2s时B物质的浓度为0.7 mol/L
其中正确的是( )
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
下列措施能明显增大原反应的化学反应速率的是( )
A.Na与水反应时增大水的用量
B.将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C.在H2SO4与NaOH两溶液反应时,增大压强
D.恒温恒容条件下,在工业合成氨反应中,增加氮气的量
查看答案和解析>>
科目:高中化学 来源:2017届陕西省宝鸡市高三上学期一检化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式 , 。
(2)铜元素基态原子的电子排布式为 ,铜单质晶体中的原子堆积模型属于 堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是 (填元素符号),第一电离能最大的是 (填元素符号)。该晶体中的阴离子的立体构型是 ,阴离子的中心原子的杂化方式为 。
(4)氨的沸点 (填“高于”或“低于”)膦(PH3),原因是 。
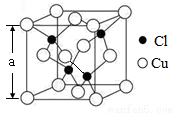
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是 。若该晶体的密度为ρg·cm-3,以NA表示阿伏加德罗常数,则该晶胞的边长为a= nm。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省铁岭市协作体高三上联考四化学试卷(解析版) 题型:选择题
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH ,模拟装置如图所示。下列说法正确的是( )
,模拟装置如图所示。下列说法正确的是( )

A. 阳极室溶液由无色变成棕黄色 B. 阴极的电极反应式为4OH--4e-===2H2O+O2↑
C. 电解一段时间后,阴极室溶液中的pH升高 D. 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com