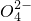本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选择其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A.(1)K
3[Fe(CN)
6]铁氰化钾又叫赤血盐.是深红色斜方晶体,易溶于水,无特殊气味,能溶于水、丙酮,不溶于乙醇.
①分子内不含有
CEF
CEF
(填序号).
A.离子键 B.极性键 C.金属键D.配位键 E.氢键 F.非极性键
②中心离子的基态电子排布式
[Ar]3d5
[Ar]3d5
.
③配位体CN
-的等电子体有
CO、N2
CO、N2
(写出两种).
④用价电子对互斥理论可知二氧化硒分子的空间构型为
V形
V形
.
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As
>
>
Se(填“>”、“<”或“=”).
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是
4
4
.
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解.向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失.
步骤II:在暗处放置30min,并不时轻轻摇动.30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内.
步骤Ⅲ:加入指示剂,用0.1mol?L
-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点.
测定过程中发生的相关反应如下:
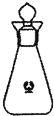
①
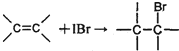
②IBr+KI=I
2+KBr
③I
2+2S
2O
32-=2I
-+S
4O
62-请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是
酸式滴定管
酸式滴定管
,碘瓶不干燥会发生反应的化学方程式
IBr+H2O=HIO+HBr
IBr+H2O=HIO+HBr
.
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是
碘瓶置于暗处可减少溴化氢挥发,不断搅动可以让物质间充分反应
碘瓶置于暗处可减少溴化氢挥发,不断搅动可以让物质间充分反应
.
(3)步骤Ⅲ中所加指示剂为
淀粉溶液
淀粉溶液
,滴定终点的现象
溶液由蓝色恰好变为无色且30秒内不变化
溶液由蓝色恰好变为无色且30秒内不变化
.

 (未配平),下列说法错误的是( )
(未配平),下列说法错误的是( )

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案

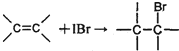
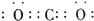
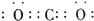


 →As
→As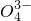 +S
+S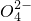 +NO↑+____
+NO↑+____ (未配平),下列说法错误的是
(未配平),下列说法错误的是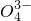 和S
和S