
【题目】韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视。一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是

A. N极为电源负极,联氨从c口通入
B. 负极上每消耗lmol N2H4,转移6mol电子
C. 正极的电极反应式为:O2+2H2O+4e-==4OH-
D. 可将联氨改进为引火性低、稳定性好的N2H4·H2O
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】某研究小组欲探究SO2的化学性质,设计了如下实验方案。
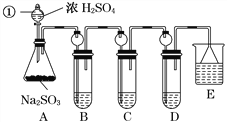
(1)指出仪器①的名称:______________。
(2)检查A装置的气密性的方法是______________________________________________。
(3)装置B检验SO2的氧化性,则B中所盛试剂可以为________。
(4)装置C中盛装溴水用以检验SO2的________性,则C中反应的离子方程式为
________________________________________________________________________。
(5)装置D中盛装新制漂白粉浓溶液,通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为__________________________________________________;
假设三:该白色沉淀为上述两种物质的混合物。
②基于假设一,同学们对白色沉淀成分进行了探究。设计如下方案:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1HCl、0.5 mol·L-1H2SO4、0.5 mol·L-1BaCl2、1 mol·L-1NaOH、品红溶液。
第1步,将D中沉淀过滤、洗涤干净,备用。
请回答洗涤沉淀的方法:____________________________________________________。
第2步,用另一只干净试管取少量沉淀样品,加入________(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有________(试剂)的试管中。若出现__________________现象,则假设一成立。
③若假设二成立,试写出生成该白色沉淀的化学方程式:_________________________________。
(6)装置E中盛放的试剂是________,作用是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:
H2C2O4![]() HC2O4-+H+ Ka1
HC2O4-+H+ Ka1
HC2O4-![]() C2O42-+H+ Ka2
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活紧密相连,下列说法错误的是
A. 衣物中的棉、麻、蚕丝灼烧后的产物不同
B. 废弃聚乙烯塑料可重新加工成防水材料或汽油等燃料,变废为宝
C. 生活中用到的碳纤维和光导纤维均为单质
D. 脂肪是有机体组织里存储能量的重要物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和数据记录都正确的是( )
A. 用托盘天平称量时,将NaOH固体放在右盘内的纸上,称得质量为10.2 g
B. 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.30 mL
C. 用干燥的广泛pH试纸测稀盐酸的pH=5.1
D. 用10 mL量筒量取NaCl溶液,体积为6.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,将X溶液逐滴加入固体Y中,下列关于试管中的现象描述不正确的是
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
|
A | 稀硫酸 | Na2O2 | 氢硫酸 | 产生淡黄色沉淀 | |
B | 浓氨水 | 碱石灰 | 氯化铝溶液 | 产生白色沉淀 | |
C | 浓硝酸 | Cu | 硅酸钠溶液 | 产生白色沉淀 | |
D | 稀盐酸 | CaCO3 | 氯化钡溶液 | 产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子在指定的分散系中能大量共存的一组是
A. 碱性溶液中:ClO-、Cl-、K+、Na+
B. 常温常压下气体:O2、N2、Cl2、NH3
C. 含有AlO2-的溶液:NO3-、HCO3-、Na+、K+
D. 氢氧化铁胶体:H+、K+、S2-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质](15分)
已知:A、B、C、D四种元素,原子序数依次增大。A是短周期元素中金属性最强的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素。试回答下列有关问题:
(1)写出D元素价电子的电子排布式___________。
(2)D可形成化合物[D(H2O)6](NO3)3。
①[D(H2O)6](NO3)3中阴离子的立体构型是 。NO3中心原子的轨道杂化类型为 。
②在[D(H2O)6]3+中D3+与H2O之间形成的化学键称为____ __,1 mol [D(H2O)6] 3+中含有的σ键有 mol。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中 (填化学式)为非极性分子。另一种物质的电子式为 。
(4)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的剖面图:

晶胞中距离一个A+最近的C有______个,这些C围成的图形是________;若晶体密度为ρ g·cm3,阿伏加德罗常数的值用NA表示,则A+的离子半径为_______cm(用含NA与ρ的式子表达)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com