
【题目】工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
样品12.0 g ![]() 溶液
溶液![]() 沉淀
沉淀![]() 固体19.7 g
固体19.7 g
(1)如何检验氯化钡溶液已过量____________
(2)检验沉淀是否洗涤干净所用到的试剂是____________
(3)样品中Na2CO3的质量分数为_________(小数点后保留1位)
【答案】取少量上层清液于试管中,加入硫酸钠溶液,若有白色沉淀生成,则氯化钡溶液已过量,反之则不过量(合理即可) 硝酸酸化的AgNO3溶液(合理即可) 88.3%
【解析】
(1)检验氯化钡溶液已过量,即检验Ba2+的存在,所以应加入含SO42-的物质。考虑到原溶液中检验,只能加入硫酸钠溶液。
(2)检验沉淀是否洗涤干净,即检验沉淀表面是否存在Cl-,所用到的试剂是硝酸酸化的硝酸银。
(3)计算Na2CO3的质量分数时,可利用Na2CO3——BaCO3,先求出Na2CO3的质量,再除以12.0,得出质量分数。
(1)检验氯化钡溶液已过量,即检验Ba2+的存在,所以应加入硫酸钠溶液,具体操作为:取少量上层清液于试管中,加入硫酸钠溶液,若有白色沉淀生成,则氯化钡溶液已过量,反之则不过量(合理即可)。答案为:取少量上层清液于试管中,加入硫酸钠溶液,若有白色沉淀生成,则氯化钡溶液已过量,反之则不过量(合理即可);
(2)检验沉淀是否洗涤干净,即检验沉淀表面是否存在Cl-,所用到的试剂是硝酸酸化的硝酸银。答案为:硝酸酸化的AgNO3溶液(合理即可);
(3)设样品中Na2CO3的质量为x

从而求出x=10.6g,样品中Na2CO3的质量分数为![]() =88.3%。答案为:88.3%。
=88.3%。答案为:88.3%。


科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是

A. X、Y依次为阳离子、阴离子选择性交换膜
B. 负极的电极反应式:BH4-+8OH-一8e-═B(OH)4-+4H2O
C. 2室流出的溶液中溶质为Na2SO4和K2SO4
D. 电路中每转移1mol电子,电极2上有32gCu析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2溶液、盐酸和K2CO3溶液。三种试剂,按下图步骤操作,下列说法错误的是( )
![]()
A.A物质是Ba(OH)2 溶液,为了除尽Mg2+和SO42-
B.B物质是碳酸钠溶液,为了除尽过量的Ba2+
C.C物质是稀盐酸 ,除去过量的CO32-
D.为了除去过量的稀盐酸,加热煮沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
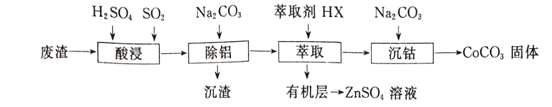
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式____________________。
(2)“除铝”过程中需要调节溶液pH的范围为_______________ 。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
(4)简述洗涤沉淀的操作____________________________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5mol/L Li2SO4水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是( )

A.该电池放电时,溶液中的SO42-向电极b移动
B.该电池负极的电极反应式为:2Li+2H2O=2LiOH+H2↑
C.电池充电时,阳极的电极反应式为:Li2Mn2O4-e-=LiMn2O4+Li+
D.电池充电时,外加直流电源的正极与电极a相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。回答下列问题:
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H1=-362 kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为__________________。
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为_______。(已知H2CO3 的Ka1=4.2×10-7,Ka2=5.6×10-11;H2S的Ka1=5.6×10-8,Ka2=1.2×10-15)
(3)在强酸溶液中用H2O2 可将COS氧化为硫酸,这一原理可用于COS 的脱硫。该反应的化学方程式为_______。
(4)COS的水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:

①该反应的最佳条件为:投料比[n(H2O)/n(COS)]__________,温度__________。
②P点对应的平衡常数为_____________ 。(保留小数点后2 位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法制备碳酸氢钠的原理为NH3+H2O+CO2 +NaCl=NH4Cl+NaHCO3↓,某化学小组用如图装置在实验室中模拟该制备过程,下列说法不正确的是
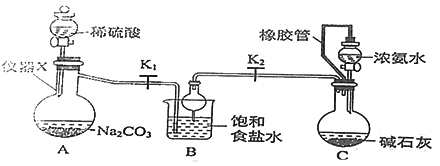
A. 装置A中仪器X的名称为蒸馏烧瓶
B. 装置B中球形干燥管的作用是防止倒吸
C. 装置C中橡胶管的作用是平衡压强,使溶液顺利滴下
D. 实验开始后,应先打开K1一段时间,然后再打开K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com