
【题目】下列叙述正确的是( )
A. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
B. 相同温度时,1mol/L氨水与0.5mol/L氨水中,c(OH-)之比是2∶1
C. 已知2SO2(g)+ O2(g)![]() 2SO3 (g)△H<0,该反应在任何温度下均可自发进行
2SO3 (g)△H<0,该反应在任何温度下均可自发进行
D. 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1 AgNO3溶液,先生成Ag2CrO4沉淀
【答案】A
【解析】A.锌比铁活泼,形成原电池反应时为负极,可保护铁不被腐蚀,为牺牲阳极的阴极保护法,A正确;B.一水合氨是弱电解质,存在电离平衡,稀释促进电离,这说明相同温度时,1mol/L氨水与0.5mol/L氨水中后者的电离常数大,因此c(OH-)之比小于2∶1,B错误;C.对于反应2SO2(g)+ O2(g)![]() 2SO3(g) △H<0,且△S<0,如能自发生进行,应满足△H-T△S<0,则应在较高温度下进行,C错误;D.假设Na2CrO4和NaCl的浓度都为0.01molL-1,AgCl饱和所需Ag+浓度c(Ag+)=Ksp(AgCl)/c(Cl)=1.8×1010/0.01mol/L=1.8×10-8mol/L,Ag2CrO4饱和所需Ag+浓度c(Ag+)=
2SO3(g) △H<0,且△S<0,如能自发生进行,应满足△H-T△S<0,则应在较高温度下进行,C错误;D.假设Na2CrO4和NaCl的浓度都为0.01molL-1,AgCl饱和所需Ag+浓度c(Ag+)=Ksp(AgCl)/c(Cl)=1.8×1010/0.01mol/L=1.8×10-8mol/L,Ag2CrO4饱和所需Ag+浓度c(Ag+)=
![]() >1.8×10-8mol/L,所以Cl-先沉淀,D错误,答案选A。
>1.8×10-8mol/L,所以Cl-先沉淀,D错误,答案选A。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】H2S与CO2在高温下发生反应:CO2 (g) + H2S (g) ![]() COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
A. 升高温度,H2S浓度增加,表明该反应是放热反应
B. 通入CO2后,正反应速率先增大后减小
C. H2S的平衡转化率α = 4.5 %
D. 反应平衡常数K = 2.8×10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g) ![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2使得压强增大
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中,有下列反应发生: ①N2 + O2 = 2NO;②2NO+O2=2NO2;③3NO2 + H2O = 2HNO3 + NO;④ 2SO2+O2 = 2SO3;⑤ SO3 + H2O = H2SO4; ⑥SO2+H2O![]() H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
A. ①②③④ B. ①②③④⑦ C. ①②④⑦ D. ①②③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少1个电子层,E原子得1个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如下图所示。
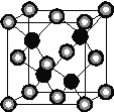
请回答下列问题:
(1)E元素的电负性________(填“>”“<”或“=”)M元素的电负性。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是___,M2E2是____(填“极性”或“非极性”)分子。
(4)L的价电子排布式为________,该元素位于周期表中的________族。
(5)R的化学式为____________(用元素符号表示),属于________晶体。已知R晶体的密度为ρg·cm-3,则该晶胞的边长a________cm。(阿伏伽德常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 澄清石灰水与过量碳酸氢钠溶液反应:![]() +Ca2++OH﹣=CaCO3↓+H2O
+Ca2++OH﹣=CaCO3↓+H2O
B. 硫酸氢钠溶液中加入氢氧化钡溶液至中性:H++![]() +Ba2++OH﹣=BaSO4↓+2H2O
+Ba2++OH﹣=BaSO4↓+2H2O
C. 向氢氧化钠溶液中通入足量CO2:2OH﹣+CO2=![]() +H2O
+H2O
D. 向氢氧化钡溶液中加入过量硫酸:2H++![]() +Ba2++2OH﹣=BaSO4↓+2H2O
+Ba2++2OH﹣=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N是短周期元素,且原子序数依次递增。已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大。Z和N可以形成ZN2型化合物。回答下列问题:
(1)元素N在周期表中的位置____________,它的最高价氧化物的化学式为____________________________________。
(2)由元素X、Y形成的一种化合物可以作为呼吸面具的供氧剂,该化合物的电子式为__________________,其所含化学键的类型为____________。
(3)用电子式表示ZN2的形成过程____________________。
(4)Z能在氮气中燃烧,Z在氮气中燃烧的产物与水反应可产生一种使湿润红色石蕊试纸变蓝的气体。写出Z在氮气中的燃烧产物与水反应的化学方程式:________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经研究发现白蚁信息素有:A. ![]() ; B.
; B. ![]() ;家蚕的信息素为:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3。试回答下列问题:
;家蚕的信息素为:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3。试回答下列问题:
(1)下列说法正确的是________(填序号)。
A.信息素A、B互为同系物
B.以上三种信息素均能使溴的四氯化碳溶液褪色
C.信息素A、B互为同分异构体
D.1mod家蚕信息素与1molBr2加成产物只有一种
(2)用系统命名法命名:信息素A的名称为___________________;信息素B与氢气加成产物的名称为_____________________________。
(3)烯烃C是信息素A的一种同分异构体,C与足量氢气加成得到烷烃D,D的一氯代物只有2种,则D的结构简式为_________________________________。
(4)写出信息素B与溴水发生反应的化学方程式________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com