
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1
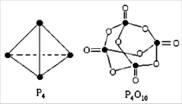
根据图示的分子结构和有关数据估算该反应的 H,其中正确的是
H,其中正确的是
A.(6a+5d-4c-12b) kJ·mol-1 B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1 D.(4a+5d-4c-12b) kJ·mol-1
科目:高中化学 来源: 题型:
氢能是一种既高效又清洁的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括( )
①原料来源广;②易燃烧、热值高;③储存方便;④制备工艺廉价易行
A.③④ B.①② C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学平衡常数K的说法中,正确的是( )
| A.K的大小与起始浓度有关 | B.温度越高,K值越大 |
| C.K值越大,反应物的转化率越大 | D.K值越大,正向反应进行的程度越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:
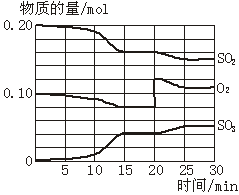 |
(1)降低温度,SO2的转化率_________,化学反应速率_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是_____ ____。
(3)反应进行至20 min时,曲线发生变化的原因是_____________________ _(用文字表达)。
10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g);ΔH = + Q kJ/mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
用pH试纸测定无色溶液的pH时,规范的操作是
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,将X和Y两种气体按不同比例放入固定容积的密闭容器中,反应达平衡后,测得X、Y的转化率与起始时物质的量之比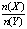 的关系如图。改变温度和压强,生成物Z的百分含量如表,则该反应的化学方程式可表示为
的关系如图。改变温度和压强,生成物Z的百分含量如表,则该反应的化学方程式可表示为
| 温度/℃ | 压强/kPa | Z的质量分数 |
| 200 | 101 | 0.40 |
| 300 | 101 | 0.48 |
| 400 | 202 | 0.52 |
| 400 | 303 | 0.52 |
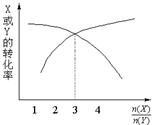
A.3X(g)+Y(g) 4Z(g);ΔH>0 B.X(g)+3Y(g)
4Z(g);ΔH>0 B.X(g)+3Y(g) 4Z(g);ΔH>0
4Z(g);ΔH>0
C.3X(g)+Y(g) 3Z(g);ΔH<0 D.X(g)+3Y(g)
3Z(g);ΔH<0 D.X(g)+3Y(g) 3Z(g);ΔH<0
3Z(g);ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )
A.氢氧化钠溶液和稀盐酸反应:H++OH-===H2O
B.大理石与盐酸反应制取二氧化碳:CO32-+ 2H+=== H2O + CO2↑
C.铁粉投入FeCl3溶液中:Fe + Fe3+===2Fe2+
D.用小苏打治疗胃酸过多:CO32-+ 2H+===CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com