
【题目】工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
【答案】MnO+2H+=Mn2++H2O 确保铁元素在后续操作中完全转化为氢氧化物沉淀而除去 Al(OH)3、Fe(OH)3 Zn+2OH--2e-=Zn(OH)2 Mn2++2H2O-2e-=MnO2+4H+ 17.4 Mn(OH)2 MnCO3 MnS
【解析】
软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)加入碳粉焙烧,MnO2转化为一氧化锰,用稀硫酸浸取,一氧化锰转化为MnSO4,同时铁和铝也和稀硫酸反应进入溶液中,用MnO2氧化Fe2+成为Fe3+,便于通过调节溶液的PH使之转化为Fe(OH)3沉淀而除去。调节溶液的PH至5.4时,Fe3+和Al3+都成为氢氧化物而除去,滤液中主要含有Mn2+,用来制取硫酸锰。
(1)一氧化锰用硫酸酸浸时生成硫酸锰和水,因此发生反应的离子方程式为MnO+2H+=Mn2++H2O;根据表中数据可知,氢氧化亚铁完全沉淀时的pH值是9.7,因此在pH等于5.4的条件下不能沉淀无法除去。而氢氧化铁完全沉淀时的pH值只有3.2,所以酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+的目的是保铁元素在后续操作中完全转化为氢氧化物沉淀而除去。
(2)根据表中数据可知,在pH等于5.4的条件下铝离子与铁离子已经完全转化为氢氧化物沉淀,因此滤渣A的成分除MnO2外,还有Al(OH)3、Fe(OH)3。
(3)MnO2是制造碱性锌锰电池的基本原料,而原电池中负极失去电子,发生氧化反应,该原电池中锌是负极,则放电时负极的电极反应式为Zn+2OH--2e-=Zn(OH)2;电解池中阳极失去电子,发生氧化反应,则工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,则锰离子在阳极放电,因此阳极的电极反应式为Mn2++2H2O-2e-=MnO2+4H+;电解池中阴极得到电子,发生还原反应,则阴极是溶液中的氢离子放电产生氢气。当阴极产生4.48L(标况)氢气,其物质的量是0.2mol,转移0.2mol×2=0.4mol电子,所以根据电子守恒可知,阳极生成二氧化锰的物质的量是0.2mol,则MnO2的理论产量为0.2mol×87g/mol=17.4g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,由于碳酸锰与硫化锰的组成特点相似,因此溶液中的锰离子浓度与溶度积常数成正比,即溶度积常数越大,锰离子浓度越大,所以Mn2+浓度是MnCO3>MnS。根据溶度积常数可知,碳酸锰和氢氧化锰溶液中Mn2+浓度分别为![]() 、
、![]() ,显然前者小于后者,所以上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是Mn(OH)2>MnCO3>MnS。
,显然前者小于后者,所以上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是Mn(OH)2>MnCO3>MnS。


科目:高中化学 来源: 题型:
【题目】现将0.04mol·L-1的某酸(A)溶液和0.02mol·L-1NaOH溶液等体积混合得混合溶液Q。
(1)若A为CH3COOH,Q呈酸性,溶液中所有离子按浓度由大到小排列的顺序是___;若A为HCl,100℃时(Kw=10-12),溶液中由水电离出的H+浓度为___mol·L-1;若A为H2S,Q接近中性,则HS-的电离能力___水解能力(填“>”“<”“=”或“无法确定”)。
(2)根据(1)中信息比较相同条件下,浓度均为0.01mol·L-1的①NaHS、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为___(填序号)。
(3)用浓度为0.01mol·L-1的NaOH溶液滴定相同体积、相同浓度的①HCl溶液、②CH3COOH溶液、③H2S溶液,当滴定至中性时,消耗NaOH溶液的体积分别为amL、bmL、cmL,则a、b、c的大小关系是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。
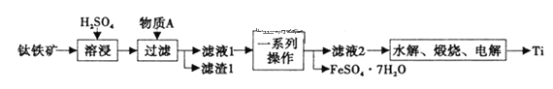
(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为___。
(2)物质A为___(填化学式),“一系列操作”为___。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有___、___。(写出两条)。
(4)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式___;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=___mol·L-1。(已知:KSP(FeCO3)=2.025×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解,且产生白雾。
(1)SO2Cl2水解的方程式为_______________________________________________
(2)某学习小组的同学依据反应:SO2(g)+ Cl2(g)![]() SO2Cl2(g);△H <0,设计制备磺酰氯装置如图:
SO2Cl2(g);△H <0,设计制备磺酰氯装置如图:
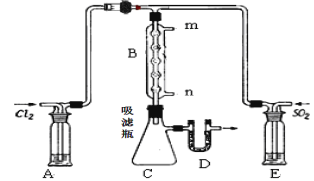
①E中所用的试剂为________________
②实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是____(选填编号);检查该装置气密性的操作是:关闭止水夹,再___________________________________

③B处反应管内五球中玻璃棉上的活性炭的作用为:_______________________D处U形管中盛放的试剂为_________________,作用 :________________________
(3)已知:以下三个反应的反应热,a、b、c均为正值
①SO2(g)+Cl2(g)+SCl2(g) ![]() 2SOCl2(g) △H=-akJ·mol-1
2SOCl2(g) △H=-akJ·mol-1
②SO2Cl2(g)+SCl2(g) ![]() 2SOCl2(g) △H=-bkJ·mol-1
2SOCl2(g) △H=-bkJ·mol-1
③SO2Cl2(l) ![]() SO2Cl2(g) △H= + ckJ·mol-1
SO2Cl2(g) △H= + ckJ·mol-1
则反应:SO2(g)+Cl2(g) ![]() SO2Cl2(l) △H=______________kJ·mol-1(用含a、b、c的代数式表示);该反应平衡常数表达式为K=___________。从化学平衡移动角度分析,反应管通水冷却的目的为____
SO2Cl2(l) △H=______________kJ·mol-1(用含a、b、c的代数式表示);该反应平衡常数表达式为K=___________。从化学平衡移动角度分析,反应管通水冷却的目的为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为![]() 制备原料为
制备原料为![]() 、
、![]() 和
和![]() ,电解液为
,电解液为![]() 的碳酸丙烯酯溶液。
的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中______区元素,其基态原子的价电子排布式为______。
(2)基态Na原子中,核外电子占据的原子轨道总数为______。
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为______![]() 用元素符号表示
用元素符号表示![]() 。
。
(4)碳酸丙烯酯的结构简式如下图所示,则其中碳原子的杂化轨道类型为______,1mol碳酸丙烯酯中σ键的数目为______。

![]() 的几何构型为正八面体形,配体是______,该配离子包含的作用力为______
的几何构型为正八面体形,配体是______,该配离子包含的作用力为______![]() 填选项字母
填选项字母![]() 。
。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如下图所示,该晶胞的密度为ρg/![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则Na与O之间的最短距离为_______________________
,则Na与O之间的最短距离为_______________________ ![]() 用含ρ、
用含ρ、![]() 的代数式表示
的代数式表示![]() 。
。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香柠檬酚具有抗氧化功能,它的结构如图,下列说法正确的是( )
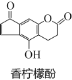
A.它的分子式为C13H9O4
B.它与H2发生加成反应,1mol最多可消耗7mol H2
C.它与溴水发生反应,1mol最多消耗3molBr2
D.它与NaOH溶液反应,1mol最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,1 mol A(g)与1 mol B(g)在催化剂作用下加热到500 ℃发生反应:A(g)+nB(g)![]() C(g)+D(g) ΔH>0达到平衡,下列判断正确的是( )
C(g)+D(g) ΔH>0达到平衡,下列判断正确的是( )
A.升高温度v(正)增大,v(逆)减小,平衡向正反应方向移动
B.平衡后再加入1 mol B,上述反应的ΔH增大
C.当n<1时,通入惰性气体,压强增大,平衡向逆反应方向移动
D.若n=1且A的转化率为50%,则平衡常数等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.![]() B.
B.![]() C.
C.![]() D.CH2 = CH—CH = CH2E.环戊烷
D.CH2 = CH—CH = CH2E.环戊烷
(1)上述有机物中互为同系物的是_____________,互为同分异构体的是____________。
(2)用系统命名法对B进行命名____________________________________。
(3)A与Cl2反应的类型为_____________;D使溴水褪色的反应类型为___________。
(4)B发生加聚反应的化学方程式为 ____________________________________。
(5)如图表示的是一种叫做双烯合成的有机反应,请写出B与D发生双烯合成所得产物的结构简式__________________。
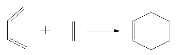
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
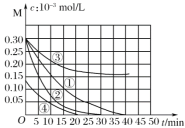
实验编号 | 温度℃ | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com