
| A、2H++2e-=H2↑ |
| B、Zn-2e-=Zn2+ |
| C、2H2O+O2+4e-=4OH- |
| D、Ag++e-=Ag |
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| A、0.5×10-3 mol |
| B、0.8×10-3 mol |
| C、1.1×10-3 mol |
| D、1.2×10-3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
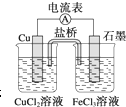 如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl溶液和琼胶做成的冻胶)( )
如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl溶液和琼胶做成的冻胶)( )| A、该原电池的总反应式为2Fe3++Cu═2Fe2++Cu2+ |
| B、该电池工作时,Cu2+在电极上得到电子,发生还原反应 |
| C、该电池工作时,氯化铜溶液中氯离子浓度增大 |
| D、电池工作过程中,电子由铜电极经过电流表流向石墨电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com