
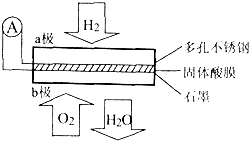
 某同体酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
某同体酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )| A、电子通过外电路从a极流向b极 |
| B、b极上的电极反应式为:O2+4H++4e-=2H2O |
| C、每转移0.4 mol电子,生成3.6g水 |
| D、H+由b极通过固体酸电解质传递到a极 |


科目:高中化学 来源: 题型:
| A、X、Y、Z的速率之比为1:2:2 |
| B、容器内各物质的浓度不随时间变化 |
| C、容器内X、Y、Z的浓度之比为1:2:2 |
| D、单位时间消耗0.1mol X同时消耗0.2mol Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家利用淡水与海水之间含盐量的差别发明了一种新型电池-水电池.
科学家利用淡水与海水之间含盐量的差别发明了一种新型电池-水电池.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化钾 | B、硫化钠 |
| C、氯化钠 | D、氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、②④ | C、①② | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.38g |
| B、4.58g |
| C、4.16g |
| D、4.41g |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 | ||||||||
B、
| ||||||||
C、 | ||||||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 氯化硼(BN)晶体是一种新型无机合成材料.用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2B4O7+2CO(NH2)2=4BN+Na2O+4H2O+2CO2↑
氯化硼(BN)晶体是一种新型无机合成材料.用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2B4O7+2CO(NH2)2=4BN+Na2O+4H2O+2CO2↑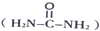 )中π键与σ键数目之比为
)中π键与σ键数目之比为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com