
【题目】最近雾霾天气肆虐我国大部分地区。其中![]() 是造成空气污染的主要原因,利用钠碱循环法可除去
是造成空气污染的主要原因,利用钠碱循环法可除去![]() 。
。
![]() 钠碱循环法中,吸收液为
钠碱循环法中,吸收液为![]() 溶液中各离子浓度由大到小的顺序为_____________。
溶液中各离子浓度由大到小的顺序为_____________。
![]() 溶液吸收
溶液吸收![]() 反应的离子方程式是__________________________________。
反应的离子方程式是__________________________________。
![]() 已知
已知![]() 的电离常数为
的电离常数为![]() ,
,![]() ;
;![]() 的电离常数为
的电离常数为![]() ,
,![]() ,则下列微粒可以大量共存的是______
,则下列微粒可以大量共存的是______![]() 填序号
填序号![]() 。
。
A.![]() 和
和![]()
![]() 和
和![]()
![]() 和
和![]()
![]() 和
和![]()
![]() 吸收液吸收
吸收液吸收![]() 的过程中,水溶液中
的过程中,水溶液中![]() 、
、![]() 、
、![]() 随pH的分布如图:
随pH的分布如图:

![]() 吸收
吸收![]() 制备
制备![]() 溶液,实验中确定何时停止通
溶液,实验中确定何时停止通![]() 的实验操作为_________________。
的实验操作为_________________。
![]() 在
在![]() 溶液中离子浓度关系不正确的是_______
溶液中离子浓度关系不正确的是_______![]() 填序号
填序号![]() 。
。
A.![]()
![]()
C.![]()
![]()
![]() 亚硫酰氯
亚硫酰氯![]() 又名氯化亚砜,是一种液态的非电解质,沸点为
又名氯化亚砜,是一种液态的非电解质,沸点为![]() 。
。![]() 中氯元素与硫元素直接以共价键相连,其中Cl呈
中氯元素与硫元素直接以共价键相连,其中Cl呈![]() 价;
价;![]() 遇水可生成
遇水可生成![]() 。请回答下列问题:蒸干
。请回答下列问题:蒸干![]() 溶液不能得到无水
溶液不能得到无水![]() ,若将
,若将 ![]() 与
与![]() 混合并加热,可制得无水
混合并加热,可制得无水![]() ,请用
,请用 ![]() 与水反应的方程式和必要的文字描述解释原因________________________________________________________。
与水反应的方程式和必要的文字描述解释原因________________________________________________________。
【答案】![]()
![]()
![]() 测量溶液的pH,若pH约为4,停止通
测量溶液的pH,若pH约为4,停止通![]()
![]()
![]() ,随着
,随着![]() 的通入,能够消耗
的通入,能够消耗![]() 分解产生的水,同时生成的HCl抑制了
分解产生的水,同时生成的HCl抑制了![]() 的水解
的水解
【解析】
(1)![]() 属于强碱弱酸盐,根据盐类水解规律,可得溶液中离子浓度大小关系。
属于强碱弱酸盐,根据盐类水解规律,可得溶液中离子浓度大小关系。
(2)![]() 溶液吸收
溶液吸收![]() 生成NaHSO3。
生成NaHSO3。
(3)根据电离常数可排出H2SO3、H2CO3、HSO3-、HCO3-的酸性强弱顺序,根据强酸可以制取弱酸的规律,可以判断给出的四组微粒间能否发生反应。
(4)![]() 由图象可知,当溶液pH约为4时,可完全反应生成
由图象可知,当溶液pH约为4时,可完全反应生成![]() ,此时可停止通入二氧化硫,故可通过测量溶液pH的方法控制何时停止通
,此时可停止通入二氧化硫,故可通过测量溶液pH的方法控制何时停止通![]() 。
。
![]() 利用盐溶液中的物料守恒、电荷守恒、质子守恒判断。
利用盐溶液中的物料守恒、电荷守恒、质子守恒判断。
(5)亚硫酰氯![]() 与水发生水解反应:
与水发生水解反应:![]() ,生成的HCl可以抑制Mg2+的水解。
,生成的HCl可以抑制Mg2+的水解。
![]() 属于强碱弱酸盐,根据盐类水解规律,可得溶液中离子浓度大小关系为:
属于强碱弱酸盐,根据盐类水解规律,可得溶液中离子浓度大小关系为:![]() ,
,
故答案为:![]() ;
;
![]() 工业上常用
工业上常用![]() 溶液来吸收
溶液来吸收![]() ,反应生成亚硫酸氢钠,该反应的离子方程式是:
,反应生成亚硫酸氢钠,该反应的离子方程式是:![]() ,
,
故答案为:![]() ;
;
![]() 已知Ka越大酸性越强,故酸性强弱顺序为:H2SO3>H2CO3>HSO3->HCO3-,酸性较强的酸能与酸性较弱的酸根离子反应,所以
已知Ka越大酸性越强,故酸性强弱顺序为:H2SO3>H2CO3>HSO3->HCO3-,酸性较强的酸能与酸性较弱的酸根离子反应,所以![]() 与
与![]() 不反应,
不反应,![]() 与
与![]() 不反应,即BC能共存,
不反应,即BC能共存,
故答案为:BC;
![]() 由图象可知,当溶液pH约为4时,可完全反应生成
由图象可知,当溶液pH约为4时,可完全反应生成![]() ,此时可停止通入二氧化硫,故可通过测量溶液pH的方法控制,
,此时可停止通入二氧化硫,故可通过测量溶液pH的方法控制,
故答案为:测量溶液的pH,若pH约为4,停止通![]() ;
;
![]() 在
在![]() 溶液中,电离程度大于水解程度,溶液显酸性,
溶液中,电离程度大于水解程度,溶液显酸性,
A.由物料守恒可知,![]() ,故A错误;
,故A错误;
B.根据质子守恒,![]() ,故B正确;
,故B正确;
C.在![]() 溶液中,电离程度大于水解程度,溶液显酸性,则离子浓度为
溶液中,电离程度大于水解程度,溶液显酸性,则离子浓度为![]() ,故C正确;
,故C正确;
D.根据电荷守恒![]() ,故D正确;
,故D正确;
故答案为:A;
![]() 蒸干
蒸干![]() 溶液时,
溶液时,![]() 会发生水解生成
会发生水解生成![]() ,且生成的HCl具有挥发性,当
,且生成的HCl具有挥发性,当![]() 与
与![]() 混合共热时,由于
混合共热时,由于![]() 极易与水反应,反应产生的HCl可以抑制
极易与水反应,反应产生的HCl可以抑制![]() 的水解,
的水解,
故答案为:![]() ,随着
,随着![]() 的通入,能够消耗
的通入,能够消耗![]() 分解产生的水,同时生成的HCl抑制了
分解产生的水,同时生成的HCl抑制了![]() 的水解。
的水解。


科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中微粒的关系正确的是![]()
A.![]() 时,
时,![]() 的氯化铵溶液中:
的氯化铵溶液中:![]()
B.![]() 时,
时,![]() 的氯化铵溶液中:
的氯化铵溶液中:![]()
C.将![]() 的醋酸溶液稀释后,恢复至原温度,pH和
的醋酸溶液稀释后,恢复至原温度,pH和![]() 均增大
均增大
D.向![]() 溶液中加入等物质的量的NaOH形成的溶液中:
溶液中加入等物质的量的NaOH形成的溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述错误的是 ( )
的变化如图所示,下列叙述错误的是 ( )
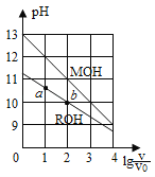
A.当lg![]() = 2时,若两溶液同时升高温度,则
= 2时,若两溶液同时升高温度,则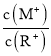 增大
增大
B.MOH的碱性强于ROH的碱性
C.ROH的电离程度:b点大于a点
D.两溶液分别与盐酸反应完全,则消耗HCl的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率
B. 食品包装材料聚乙烯因发生加成反应而易老化
C. ![]() 的名称为4—苯基—2—丁醇
的名称为4—苯基—2—丁醇
D. 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】螺环化合物具有抗菌活性,用其制成的药物不易产生抗药性,螺[3,4]辛烷的结构如图,下列有关螺[3,4]辛烷的说法正确的是( )

A. 分子式为C8H16B. 分子中所有碳原子共平面
C. 与2—甲基—3—庚烯互为同分异构体D. 一氯代物有4种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺式乌头酸是一种重要的食用增味剂,其结构简式如图所示。下列有关说法错误的是( )
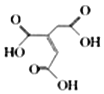
A.该有机物的分子式为:C6H6O6
B.该有机物分子中含有两种官能团
C.该有机物能使酸性KMnO4溶液、溴的四氯化碳溶液褪色,且原理相同
D.相同条件下,等量的顺式乌头酸分别与足量的NaHCO3、Na反应,产生气体的体积比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A有如下的转化关系: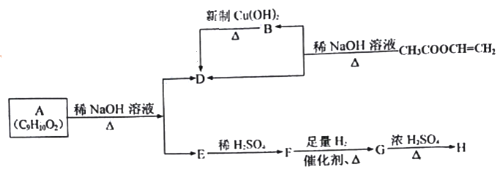
已知:![]() 当羟基与双键碳原子相连接时,易发生如下转化:
当羟基与双键碳原子相连接时,易发生如下转化:
![]()
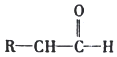
![]() 可与
可与![]() 溶液发生显色反应。
溶液发生显色反应。
![]() 的反应中,有机产物只有一种结构且能使溴水褪色。
的反应中,有机产物只有一种结构且能使溴水褪色。
请回答下列问题:
![]() 的结构简式为______。
的结构简式为______。![]() 中含有的官能团名称为______。
中含有的官能团名称为______。
![]() 的化学方程式为______,
的化学方程式为______,![]() 的化学方程式为______。
的化学方程式为______。
![]() 上述合成过程中没有涉及的反应类型有______
上述合成过程中没有涉及的反应类型有______![]() 填字母
填字母![]() 。
。
![]() 取代反应
取代反应 ![]() 酯化反应
酯化反应 ![]() 加成反应
加成反应 ![]() 消去反应
消去反应 ![]() 氧化反应
氧化反应 ![]() 还原反应
还原反应
![]() 的名称______,与F不同类且含苯环的同分异构体的结构简式为______。
的名称______,与F不同类且含苯环的同分异构体的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2与人们的日常生活、生产和科学研究密不可分,综合利用CO2是解决能源问题的有效途径之一。回答下列问题:
(1)用CaSO4代替O2与燃料CO反应,能得到较纯的CO2,有关反应如下:
①CaSO4(s)+4CO(g)=CaS(s)+4CO2(g) ΔH1=-189.2kJmol-1(主反应)
②CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5kJmol-1(副反应)
③CO(g)=![]() C(s)+
C(s)+![]() CO2(g) ΔH3=-86.2kJmol-1(副反应)
CO2(g) ΔH3=-86.2kJmol-1(副反应)
则反应2CaSO4(s)+7CO(g)=CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=___。
(2)已知CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH。向一密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)=0.2molL-1,c(H2)=0.8molL-1,c(H2O)=1.6molL-1。若200℃时该反应的平衡常数K=64.8,则该反应的ΔH___(填“>”或“<”)0。
(3)一定条件下,CO2还可以转化为低碳烯烃,反应的化学方程式为2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH,在两个容积均为2L的恒容密闭容器中以不同的氢碳比[![]() ]充入H2和CO2,CO2的平衡转化率α(CO2)与温度的关系如图所示。
]充入H2和CO2,CO2的平衡转化率α(CO2)与温度的关系如图所示。
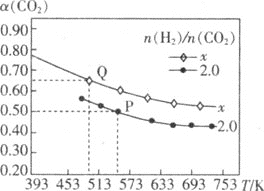
①x___(填“>”“<”或“=”)2.0。
②若起始加入的CO2、H2的物质的量分别为1mol和2mol,则P点时的平衡常数K=___。
③比较P点和Q点的化学平衡常数:Kp___(填“>”“<”或“=”)KQ,理由是___。
(4)据报道,以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示。

①a极发生___(填“氧化”或“还原”)反应。
②电解时,b极上生成乙烯的电极反应为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com