
【题目】H2SO3水溶液中存在电离平衡H2SO3![]() H++ HSO3- 和HSO3-
H++ HSO3- 和HSO3-![]() H++ SO32-,若对H2SO3溶液进行如下操作,则结论正确的是:( )
H++ SO32-,若对H2SO3溶液进行如下操作,则结论正确的是:( )
A.通入氯气,溶液中氢离子浓度增大
B.通入过量H2S,反应后溶液pH减小
C.加入氢氧化钠溶液,平衡向右移动,pH变小
D.加入氯化钡溶液,平衡向右移动,会产生亚硫酸钡沉淀
科目:高中化学 来源: 题型:
【题目】已知空气组成(体积分数)N2:0.800,O2:0.200,氨空气氧化后的混合气体组成如下(高温下NO与O2可以共存)NO:16 mol;O2:7.00 mol;H2O:24.5 mol;N2:112 mol。
完成下列计算:
(1)该混合气体中NO全部转化为HNO3,需要___________摩尔O2 。
(2)参加反应的空气的体积是___________升。(标准状况下)
(3)向该混合气体中添加空气使NO完全转化为 HNO3,转化后剩余气体中(不含H2O)氧气体积分数为0.0500。添加空气多少摩尔?___________
(4)该混合气体的组成表明NH3氧化产生的NO超过16 mol,有部分NO已和O2、H2O 反应转化为HNO3。这部分NO是多少摩尔? _______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:

(1)将菱锌矿研磨成粉的目的是_______________________。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是______________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
工业上从“滤液3”制取MgO过程中,最合适的反应物是______________(选填序号)。
A、大理石粉 B、石灰乳 C、纯碱溶液 D、烧碱溶液
“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(4)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末。制备CuBr的实验步骤如下:
步骤1.在如图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2 2小时。
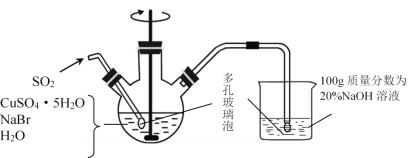
步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤。
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去其中水中的______________(写化学式)。
(2)步骤1中:①三颈烧瓶中反应生成CuBr的离子方程式为_______________;
②控制反应在60℃进行,实验中可采取的措施是_____________;
③说明反应已完成的现象是__________________。
(3)步骤2过滤需要避光的原因是_______________。
(4)步骤3中洗涤剂需“溶有SO2”的原因是_____________________最后溶剂改用乙醚的目的是________________________________。
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。请补充实验步骤(须用到SO2(贮存在钢瓶中)、20%NaOH溶液、乙醇)
①_______________________________________________。
②__________________________________________________。
③加入少量维生素C溶液(抗氧剂),蒸发浓缩,冷却结晶。
④__________________________________________________。
⑤放真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00 L的密闭容器中,充入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随着温度升高,混合气体的颜色变深。体系中各物质的浓度变化与时间关系如图所示。下列说法正确的是
2NO2(g),随着温度升高,混合气体的颜色变深。体系中各物质的浓度变化与时间关系如图所示。下列说法正确的是
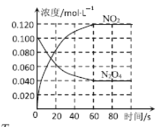
A.反应的△H <0
B.在 060s 时段,反应速率v(N2O4)=0.001mol·L-1·s-1
C.平衡时,反应的平衡常数K=0.240
D.T1℃时平衡后将温度变为T2℃,测得c(N2O4)降低,则T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮有多种化合价,能形成多种化合物.工业上用活性炭还原法处理NO,有关反应为:C(s)+2NO(g)N2(g)+CO2(g).向密闭的2L容器中,加入NO和足量的活性炭,恒温条件下反应.
(1)若2min内气体密度增大了1.2g/L,则氮气的平均反应速率为_____mol/(Lmin).
(2)该化学平衡常数表达式K=_____,已知升高温度时,K增大,则正反应为_____(填“吸热”或“放热”)反应.
(3)在温度不变的情况下,要提高NO的平衡转化率,可以采取的措施是_______.
(4)下列各项能判断该反应达到平衡的是______(填序号字母).
a.容器内压强保持不变 b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
(5)已知NaNO2溶液呈碱性,则NaNO2溶液中离子浓度由大到小的顺序是______.
(6)常温下,NaOH溶液和HNO2溶液等体积混合后,所得溶液的pH=7,下列关系正确的是________.
a.c(Na+)>c(NO2﹣) b.c(Na+)=c(NO2﹣)
c.c(Na+)<c(NO2﹣) d.c(Na+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知蓄电池在充电时作电解池,放电时作原电池.如图是铅蓄电池的工作示意图,其反应原理为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O下列说法中错误的是( )
2PbSO4+2H2O下列说法中错误的是( )

A.b电极放电后转化为c电极
B.电极a和d都发生还原反应
C.b的电极反应式:Pb+SO42﹣﹣2e-→PbSO4
D.放电后硫酸溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:K3[Fe(CN)6]溶液是检验Fe2+的试剂,若溶液中存在Fe2+,将产生蓝色沉淀。将0.2mol/L的KI溶液和0.05mol/LFe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①B.②和④C.③和④D.①和②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com