
已知“凡气体分子总数增多的反应一定是熵增大的反应”.根据所学知识判断,下列反应中,在所有温度下都不自发进行的( )
|
| A. | 2O3(g)═3O2(g)△H<0 | B. | 2CO(g)═2C(s)+O2(g)△H>0 |
|
| C. | N2(g)+3H2(g)═2NH3(g)△H<0 | D. | CaCO3(s)═CaO(s)+CO2(g)△H>0 |
考点:
反应热和焓变.
专题:
化学反应中的能量变化.
分析:
反应能否自发进行取决于△G=△H﹣T•△S,当△G=△H﹣T•△S<0时,反应可自发进行,否则不能.
解答:
解:A.△H<0,△S>0,根据△G=△H﹣T•△S可知,一般温度下都能满足△H﹣T•△S<0,反应可自发进行,故A不选;
B.△H>0,△S<0,一般情况下都满足△G=△H﹣T•△S>0,反应不能自发进行,故B选;
C.△H<0,△S<0,在较高温度下,可满足△H﹣T•△S<0,反应可自发进行,故C不选;
D.△H>0,△S>0,在较高温度下,可满足△H﹣T•△S<0,反应可自发进行,故D不选.
故选:B.
点评:
本题考查反应热与焓变,题目难度不大,注意反应能否自发进行,取决于△H﹣T•△S是否小于0.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
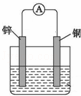
铜﹣锌原电池如图所示,电解质溶液为稀硫酸,当该原电池工作时( )
|
| A. | 铜电极上发生氧化反应 |
|
| B. | 电子从铜电极经外电路流向锌电极 |
|
| C. | 电解质溶液中氢离子浓度不变 |
|
| D. | 当锌溶解65克时,铜电极上产生的气体体积为22.4L(标况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能成功的是( )
|
| A. | 将乙酸和乙醇混合加热制乙酸乙酯 |
|
| B. | 苯和稀硝酸反应制硝基苯 |
|
| C. | CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀 |
|
| D. | 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛溶液,加热煮沸观察红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式书写正确的是( )
|
| A. | NaHCO3=Na++H++CO32﹣ | B. | HF⇌H++F﹣ |
|
| C. | H2CO3⇌2H++CO32﹣ | D. | CH3COONH4⇌CH3COO﹣+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,能证明某物质是弱电解质的是( )
|
| A. | 熔化时不导电 |
|
| B. | 水溶液的导电能力很差 |
|
| C. | 不是离子化物,而是极性共价化合物 |
|
| D. | 溶液中已电离的离子和未电离的分子共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
今有①盐酸、②醋酸、③硫酸三种稀溶液,用序号回答下列问题.
(1)若三种酸的物质的量浓度相等.
a.三种溶液中的c(H+)大小关系为 .
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小关系为 .
(2)若三种酸溶液中的c(H+)相等.
a.三种酸的物质的量浓度大小关系为 .
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.每一周期的元素都是从碱金属开始,最后以稀有气体结束
B.同一周期中(除第一周期外),从左到右,各元素原子核的电子数都是从1个逐渐增加到8个
C.第二、三周期上下相邻元素的原子核外电子数相差8个
D.第七周期只有23种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
)磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下。
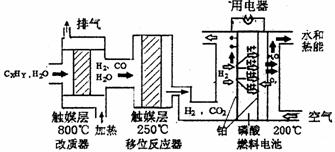
(1)在改质器中主要发生的反应为_______________________________
(2)移位反应器中CO(g)+H2O (g) 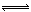 CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
| t/min | COmol/L) | H2O(mol/L) | CO2(mol/L) | H2(mol/L) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.1 |
| 3 | n1 | n2 | n3 | 0.1 |
| 4 | 0.09 | 0.19 | 0.11 | 0.11 |
①此温度下,该反应的平衡常数为________
②反应在3~4 min之间,氢气的物质的量增多的原因可能是 (填代号)
A.充入水蒸汽 B.升高温度 C.使用催化剂 D.充入氢气
(3)磷酸燃料电池负极排出的气体主要是___ __,
该电池正极的电极反应为_ _ __。
(4)磷酸燃料电池的电极上镀了铂粉,这样做的目的,除了起到更好的导电作用外,还具备的作用是 。
(5)总体看来,整个体系中能量来自与CxHy与空气的反应,假设CxHy为辛烷,且
已知辛烷的燃烧热为5 518 kJ·mol-1,请写出辛烷燃烧热的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com