
【题目】把1 L 0.1 mol/L的醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是( )
A. c(CH3COOH)变为原来的1/10
B. c(H+)变为原来的![]()
C. c(CH3COO-)/c(CH3COOH)的比值增大
D. 溶液的导电性增强
【答案】C
【解析】1L0.1mol/L的醋酸溶液稀释到10L,溶液体积变为原来的10倍。A项,加水稀释促进CH3COOH的电离,H+、CH3COO-物质的量增大,CH3COOH物质的量减小,则c(CH3COOH)比原来的1/10小,错误;B项,c(H+)比原来的1/10大,错误;C项,c(CH3COO-)/c(CH3COOH)= n(CH3COO-)/n(CH3COOH),n(CH3COO-)增大,n(CH3COOH)减小,n(CH3COO-)/n(CH3COOH)的比值增大,正确;D项,由于溶液体积的增大超过离子物质的量的增大,c(H+)、c(CH3COO-)减小,溶液导电性减弱,错误;答案选C。


科目:高中化学 来源: 题型:
【题目】已知分解反应2N2O5(g)![]() 4NO2(g) + O2(g)的速率方程式v = k·cm(N2O5),k是与温度有关的常数,实验测定340K时的有关数据及根据相关数据做出的图像如下:
4NO2(g) + O2(g)的速率方程式v = k·cm(N2O5),k是与温度有关的常数,实验测定340K时的有关数据及根据相关数据做出的图像如下:
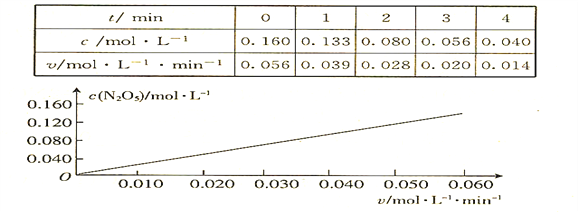
依据图表中的有关信息,判断下列有关叙述中不正确的是
A. 340K时,速率方程式中的m = 1
B. 340K时,速率方程式中的k = 0.350 min-1
C. 340K时,c(N2O5)= 0.100 mol·l-1时,v = 0.035 mol·l-1 ·min-1
D. 340K时,压强增大一倍,逆反应速率不变,正反应速率是原来的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,经测定一瓶气体中只含C和O两种元素,通常情况下这瓶气体不可能是
A.一种化合物B.两种单质
C.两种化合物D.一种单质和一种化合物的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)100°C时,KW=1.0×10﹣12,在该温度下,测得0.1mol/LNa2A溶液pH=6.
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,与盐酸相比,H2A溶液产生的H2____(填“多”、“少”或“一样多”).
(2)将0.4 mol/L HB溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)>c(B-)。
①混合溶液中c(B﹣)_____c(HB)(填“>”、“<” 或“=”);
②混合溶液中c(HB)+ c(B-)_____0.2mol/L(填“>”、“<”或“=”).
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
溶质 | CH3COOH | H2CO3 | HClO | HCN |
电离平衡常数Ka | 1.75×10-5 | Ka1=4.4×10-7 Ka2=4.7×10-11 | 3.2×10-8 | 6.2×10-10 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c( CH3COO-)﹣c( CH3COOH)=___mol/L(用数值列出计算式即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2用作橡胶的低温硫化剂和粘结剂,由硫与限量氯气在50~60℃反应制得,进一步氯化可得SCl2、S2Cl2、SCl2的某些性质如下:
水溶性 | 密度(g/cm3) | 颜色 | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,通水即分解 | 1.687 | 金黄色 | -76℃ | 138℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | 樱桃红 | -122℃ | 59℃ |
用如图所示装置制备S2Cl2回答下列问题:
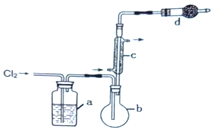
(1)写出S2Cl2的电子式_________。
(2)写出仪器c的名称_________;实验开始前先在b中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一固体薄层,这样做的目的是_________。
(3)实验时,b装置需加热。最好采用何种方式加热_________。
(4)b中的反应开始前,需排除装置中的空气,简述相关操作:_________。
(5)装置d中盛放的试剂是_________;其作用是①_________②_________。
(6)为了获得更纯净的S2Cl2,需要对产品进行的操作是_________。
(7)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g) + 4H2(g)![]() CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
A. 该反应的ΔH < 0 B. 化学平衡常数K增大
C. CO2的转化率增加 D. 正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理超标电镀废水,使其NaCN含量低于0.5 mg/L,即可达到排放标准,反应分两步进行。第一步NaCN与NaClO反应,生成NaOCN和NaCl。第二步NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。已知HCN是弱酸,易挥发,有剧毒;HCN、HOCN中N元素的化合价相同。下列说法正确的是
A. 处理NaCN超标电镀废水的过程中无元素化合价的改变
B. 第一步反应溶液应调节为酸性,可避免生成有毒物质HCN
C. 第二步发生的反应为2OCN- + 3ClO- ![]() 2CO2↑ + CO32 + 3Cl- + N2↑
2CO2↑ + CO32 + 3Cl- + N2↑
D. 处理100 m3含NaCN 10.3 mg/L的废水实际至少需要50 mol NaClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com