
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
分析 由元素在周期表的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为S,G为F,H为Cl,I为Ne,
(1)稀有气体的性质最稳定,F的非金属性最强;
(2)Na的金属性最强,高氯酸为所有含氧酸中酸性最强的酸;
(3)非金属性越强,对应氢化物越稳定;
(4)电子层越多,离子半径越大,具有相同电子排布的离子中,原子序数大的离子半径小;
(5)NaOH与氢氧化铝反应生成偏铝酸钠和水.
解答 解:由元素在周期表的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为S,G为F,H为Cl,I为Ne,
(1)稀有气体的性质最稳定,F的非金属性最强,则表中元素,化学性质最不活泼的是Ne,氧化性最强的单质是F2,故答案为:Ne;F2;
(2)Na的金属性最强,高氯酸为所有含氧酸中酸性最强的酸,则最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,故答案为:NaOH;HClO4;
(3)F的非金属性最强,A分别与D、E、F、G、H形成的化合物中,最稳定气态氢化物是HF,故答案为:HF;
(4)电子层越多,离子半径越大,具有相同电子排布的离子中,原子序数大的离子半径小,则B、C、F、H中,离子半径从大到小的顺序是S2->Cl->Na+>Al3+,
故答案为:S2->Cl->Na+>Al3+;
(5)NaOH与氢氧化铝反应生成偏铝酸钠和水,离子反应为OH-+Al(OH)3=AlO2-+2H2O,故答案为:OH-+Al(OH)3=AlO2-+2H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:实验题
 (1)现需配制0.1mol/LNaOH溶液500mL,装置是某同学转移溶液的示意图
(1)现需配制0.1mol/LNaOH溶液500mL,装置是某同学转移溶液的示意图查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与足量氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| D. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与电源正极相连的是电解槽的阴极 | |
| B. | 与电源负极相连的电极发生还原反应 | |
| C. | 在电解槽的阳极发生氧化反应 | |
| D. | 电子从电源的负极沿导线流入阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
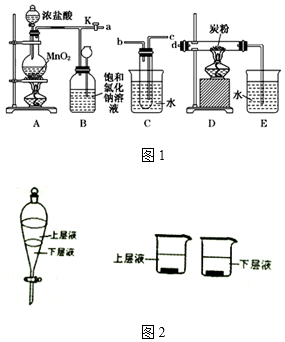
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)△H
(1)已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)△H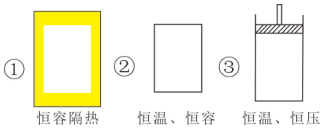
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 三种酸的电离常数关系:KHA>KHB>KHD | |
| B. | 滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com