
【题目】下列过程或现象与盐类水解无关的事
A. 纯碱溶液去油污
B. 明矾可以净水
C. 加热氯化铁溶液颜色加深
D. 铁在潮湿的环境下生锈
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】金属及其化合物有许多重要的用途
(1)碳酸钠可用于从海水提取溴,涉及的反应如:
3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3
在上述反应中用双线桥标出电字转移的方向和数目,该反应中氧化剂与还原剂的物质的量之比是_____________。
(2)少量的钠应保存在_______中;钠着火时应采取的灭火措施是:__________。
(3)过氧化钠作潜艇供氧剂时发生的化学反应方程式是_____________。
(4)加热Al片的实验现象是_________________,原因是_____________。
(5)检验KCl中阳离子的方法及现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2(g)+O2(g)2SO3(g),能增大正反应速率的措施是( )
A.通入大量O2 B.增大容器容积 C.移去部分SO3 D.降低体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 分子式为C7H8O含有苯环且属于醇类的同分异构体有4种
B. 乙炔能使溴的四氯化碳溶液褪色是发生了氧化反应
C. 苯分子中所有原子都在同一平面上
D. 乙酸乙酯少量乙酸杂质可加饱和NaOH溶液后经分液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在人类生活中扮演重要角色,下列说法正确的是
A. 蔬菜和粗粮中富含纤维素,纤维素在人体中酶的作用下能水解成葡萄糖
B. 混凝法、中和法、沉淀法、氧化还原法是工业处理废水常用的方法
C. 可只用淀粉溶液检验食盐中是否加碘
D. 鸡蛋清溶液中加人饱和Na2SO4溶液,有沉淀生成是因为蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 凡是吸热反应都是非自发的
B. 所有的反应都需要活化能的推动才能发生
C. 焓变和熵变是判断反应方向的两个主要因素
D. 自发反应在任何条件下都能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产中用途广泛。
Ⅰ.从含铜丰富的自然资源黄铜矿(CuFeS2)冶练铜的工艺流程如下:
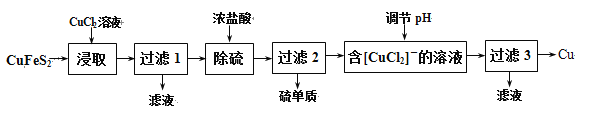
已知:CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为 。
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为 。
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是 。(填离子符号)
(4)过滤3所得滤液中可以循环使用的物质有 ,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为 。
Ⅱ.利用生产硼砂的废渣——硼镁泥(主要成分为MgCO3、SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3·Mg(OH)2·2H2O]的工业流程如下:
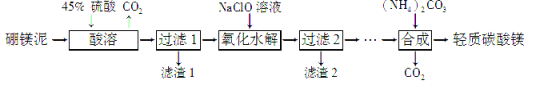
(1) 写出“酸溶”一步中,MgCO3和硫酸反应的离子方程式 。
(2) 滤渣2的主要成分有MnO2和_____________,写出生成MnO2的离子方程式____________________。
(3)“合成”时需通蒸汽至80 ℃,边加热边搅拌,温度控制在80 ℃的原因是________________________(只需写出相应的化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是分析化学中常用实验方法,请根据滴定法的有关知识回答下列问题:
Ⅰ、某学生用0.1 mol·L-1 的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上1~2cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_________AF。
(2)上述B步骤操作的目的是______________。
(3)在进行C步操作滴定前排气泡时,应选择下图2中的__________(填序号),若用25mL滴定管进行实验,当滴定管中的液面在“10”处,则管内液体的体积(填序号)__________(①=10mL,②=15mL,③<10mL,④>15mL)。

(4)判断以下操作,对测定结果盐酸浓度的影响(填“偏高”、“偏低”或““无影响”)
①上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是_________。
②若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是___________。
③如果滴定前装有待测溶液的酸式滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将____________。
Ⅱ、氧化还原滴定法实际生产中运用较为广泛的方法。制备纳米TiO2的方法之一是TiCl4在加热条件下水解生成TiO2·xH2O,经过过滤、水洗除去其中的Cl-,再经烘干、焙烧除去水分,最后得到粉体TiO2。
可用氧化还原滴定法测定TiO2的质量分数。在一定条件下,将粉体溶解并将溶液中的Ti2-氧化为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。【注:NH4Fe(SO4)2是一种复盐,含有两种阳离子】。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________。
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量稀H2SO4的原因是____________________,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需用到图中的______________(填序号)
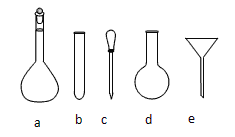
检验TiO2·xH2O中Cl-是否被除净的方法是________________________。
(3)滴定终点的现象是:当滴入最后一滴NH4Fe(SO4)2标准溶液时_______________________。
(4)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)粉体试样wg,消耗v ml c mol·L-1 NH4Fe(SO4)2标准溶液。则TiO2质量分数表达式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在密闭容器中、一定条件下进行的可逆反应N2(g)+3H2(g)![]() 2NH3(g),能说明反应已达到平衡状态的是
2NH3(g),能说明反应已达到平衡状态的是
A. 各物质体积分数相等 B. c(NH3)保持不变
C. 各物质浓度相等 D. c(NH3)∶c(N2)∶c(H2)=2∶1∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com