

分析 含镍(Ni2+)废液为原料生产NiOOH,在含Ni+的废液中中加入碳酸钠溶液,过滤得到NiCO3沉淀,沉淀中加入硫酸溶解生成NiSO4,加入试剂调节溶液的pH使镍离子全部沉淀生成Ni(OH)2,在空气中加热Ni(OH)2制取NiOOH;
(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀;
(2)依据溶度积常数计算溶液中氢氧根离子浓度,结合离子积常数计算溶液中的氢离子浓度,pH=-lgc(H+);
(3)空气中加热Ni(OH)2和空气中氧气反应生成NiOOH和水;
(4)消耗KMnO4物质的量:0.01 mol•L-1×0.02L=2×10-4 mol,
与NiOOH反应后剩余的Fe2+物质的量:2×10-4 mol×5×(200÷20)=0.01 mol,
Fe2+总物质的量:1.0 mol•L-1×0.1 L=0.1 mol,
与NiOOH反应的Fe2+的物质的量:0.1 mol-0.01 mol=0.09 mol,
得到n(NiOOH)=0.09 mol,计算得到NiOOH的质量,得到混合物中Ni(OH)2的质量,计算物质的量,依据xNiOOH•yNi(OH)2计算x和y的比值.
解答 解:(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀,具体操作步骤为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成;
故答案为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成;
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol•L-1,
Ksp[Ni(OH)2]=c(Ni2+)×c2(OH-)=2×10-15,c(OH-)=$\sqrt{\frac{2×1{0}^{-15}}{2×1{0}^{-5}}}$=10-5mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,则pH=9;
由于c(Ni2+)≤2×10-5 mol•L-1,则调节pH的范围是:pH≥9,
故答案为:pH≥9;
(3)空气中加热Ni(OH)2和空气中氧气反应生成NiOOH和水,原子守恒配平书写化学方程式为:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O,
故答案为:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
(4)消耗KMnO4物质的量:0.01 mol•L-1×0.02L=2×10-4 mol
与NiOOH反应后剩余的Fe2+物质的量:2×10-4 mol×5×(200÷20)=0.01 mol
Fe2+总物质的量:1.0 mol•L-1×0.1 L=0.1 mol
与NiOOH反应的Fe2+的物质的量:0.1 mol-0.01 mol=0.09 mol
n(NiOOH)=0.09 mol
m(NiOOH)=91.7 g•mol-1×0.09 mol=8.253 g
n[Ni(OH)2]=$\frac{9.18g-8.253g}{92.7g•mol-1}$=0.01mol,
x:y=n(NiOOH):n[Ni(OH)2]=0.09 mol:0.01 mol=9:1,
即x=9、y=1,
故答案为:9;1.
点评 本题考查了物质分离方法和实验过程分析判断、溶度积常数和离子积常数的计算应用,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:填空题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加2.24g随着CO2的继续通入,活塞又逐渐向右移动.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2?N2O4(不考虑活塞的摩擦)下列说法中正确的是( )
如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加2.24g随着CO2的继续通入,活塞又逐渐向右移动.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2?N2O4(不考虑活塞的摩擦)下列说法中正确的是( )| A. | 活塞从D处移动到C处的过程中,通入CO2体积为2.24L(标准状况) | |
| B. | NO2转化为N2O4的转换率为20% | |
| C. | 活塞移至C处后,继续通入0.01mol CO2,此时活塞恰好回到D处 | |
| D. | 若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入CO2的量,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量应大于1.56g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 银电极是负极 | B. | X电极是锌电极 | ||
| C. | 去掉盐桥电流计指针仍偏转 | D. | Y溶液为AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ•mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ•mol-1,能量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑ | B. | Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑ | ||
| C. | 2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水煤气反应中,生成1molH2(g)吸收131.4 kJ热量 | |
| B. | CO(g)+H2(g)?C(s)+H2O(g)△H=+131.4kJ•mol-1 | |
| C. | 水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 | |
| D. | 反应物能量总和大于生成物能量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

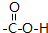 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取8.0 g CuSO4,加入500 mL水 | |
| B. | 称取7.68 g CuSO4,加入480 mL水 | |
| C. | 称取12.5 g CuSO4•5H2O,加水配成500 mL溶液 | |
| D. | 称取12.0 g CuSO4•5H2O,加水配成480 mL溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com