
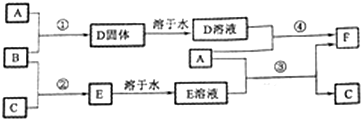
分析 A是用途最广的金属,为Fe,B、C是两种常见气体单质,二者反应生成E,E溶液为常见强酸,B、C分别为H2、Cl2中的一种,则E为HCl,B与Fe反应生成D,则B为Cl2,C为H2,D为FeCl3,FeCl3溶液中滴加KSCN溶液显红色,符合题意,A(Fe)与FeCl3溶液反应生成F,则F为FeCl2,A(Fe)与E溶液(盐酸)反应生成FeCl2、H2,符合转化关系.
解答 解:A是用途最广的金属,为Fe,B、C是两种常见气体单质,二者反应生成E,E溶液为常见强酸,B、C分别为H2、Cl2中的一种,则E为HCl,B与Fe反应生成D,则B为Cl2,C为H2,D为FeCl3,FeCl3溶液中滴加KSCN溶液显红色,符合题意,A(Fe)与FeCl3溶液反应生成F,则F为FeCl2,A(Fe)与E溶液(盐酸)反应生成FeCl2、H2,符合转化关系.
(1)由上述分析可知,B为Cl2;F为FeCl2;
故答案为:Cl2;FeCl2;
(2)Fe与水蒸气在高温条件下反应生成四氧化三铁与氢气,反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)FeCl2溶液中滴入NaOH溶液先生成白色的Fe(OH)2,Fe(OH)2不稳定,被氧化为Fe(OH)3,立即变成灰绿色,最后变成红褐色,故产生的实验现象是:先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色;
故答案为:先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色;
(4)将FeCl3的饱和溶液滴加到沸水中可以制得氢氧化铁胶体,该反应的化学反应方程式:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
(5)在100mL的FeCl2溶液中通入标准状况224mLCl2,FeCl2溶液恰好转化成FeCl3溶液,发生反应:2Fe2++Cl2=Fe3++2Cl-,氯气物质的量为$\frac{0.224L}{22.4L/mol}$=0.01mol,由方程式可知FeCl2为0.02mol,则原FeCl2溶液的物质的量浓度为$\frac{0.02mol}{0.1L}$=0.2mol/L,
故答案为:0.2mol/L.
点评 本题为框图型物质推断题,物质的颜色、性质、状态等是推断突破口,旨在考查元素单质及其化合物的性质,难度中等,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质,然后顺推或逆推或由两边向中间推得出其他物质.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5?mol•L-1 | B. | 2.5?mol•L-1 | C. | ?d/400 mol•L-1 | D. | ?d/200mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO)=1.6 mol/(L•min) | B. | v(N02)=0.9 mol/(L•min) | ||
| C. | V(N2)=0.25 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质编号 | 物质转化关系 | a | b | c | d |
| A | 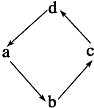 | N2 | NO2 | NO | HNO3 |
| B | Na | Na2O2 | NaOH | NaCl | |
| C | Si | SiO2 | H2SiO3 | Na2SiO3 | |
| D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com