
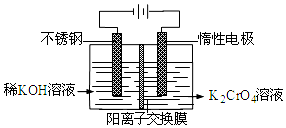
| A. | 在阴极式,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 铬原子的价电子排布式为3d44S2 |
分析 电解时,阳极发生氧化反应,水失去电子放电,电极反应为:2H2O-4e-=4H++O2↑,阳极区酸性逐渐增强,则平衡2CrO42-+2H+?Cr2O72-+H2O向右移动,溶液逐渐由黄色变为橙色,阴极发生2H2O+2e-═2OH-+H2↑,以此解答该题.
解答 解:A.电极均为惰性电极,在阴极室发生还原反应,水得电子变成氢气,电极方程式为2H2O+2e-═2OH-+H2↑,故A正确;
B.电解时,阳极发生氧化反应,水失去电子放电,电极反应为:2H2O-4e-=4H++O2↑,阳极区酸性逐渐增强,则平衡2CrO42-+2H+?Cr2O72-+H2O向右移动,溶液逐渐由黄色变为橙色,故B正确;
C.阴极电极反应为:4H2O+4e-=4OH-+2H2↑,阳极反应为:2H2O-4e-=4H++O2↑,4CrO42-+4H+═2Cr2O72-+2H2O,总电解方程式为4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑,故C正确;
D.铬原子的价电子排布式为3d54S1,故D错误.
故选D.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应是解本题关键,侧重考查学生分析判断能力,知道电解质中离子移动方向,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 2SO2(g)+O2(g)?2SO3(g)(正反应是放热反应) | |
| B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)(正反应是放热反应) | |
| C. | 2NH3(g)?N2(g)+3H2(g)(正反应是吸热反应) | |
| D. | SO2(g)+NO2(g)?SO3(g)+NO(g)(正反应是放热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏都属于化学变化 | |
| B. | 石油裂化获得的产品是混合物 | |
| C. | 石油主要含C、H、O三种元素 | |
| D. | 煤焦油经过分馏可得到苯、甲苯等,说明煤中含有苯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁比软铁芯(几乎是纯铁)容易生锈 | |
| B. | 银质奖牌久置后表面变暗 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com