
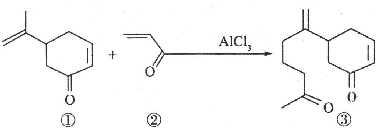
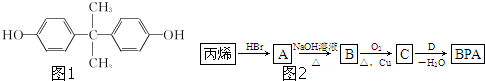
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、测得该液体pH=7 |
| B、电解该液体得到氢气和氧气,测其体积比为2﹕1 |
| C、向其中投入金属钠,钠于液面上迅速游动,并发出嘶嘶声 |
| D、在1.01×105 Pa压强下测得沸点为373.15K |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、任何化学反应都伴随着能量变化 |
| B、放热反应的反应速率总是大于吸热反应的反应速率 |
| C、离子化合物中一定含有离子键,可能含有共价键 |
| D、强电解质与弱电解质的区别就是电解质在水溶液中是否完全电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
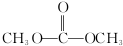 ).有机物W是碳酸二甲酯的同分异构体,W具有如下特征:
).有机物W是碳酸二甲酯的同分异构体,W具有如下特征:查看答案和解析>>
科目:高中化学 来源: 题型:
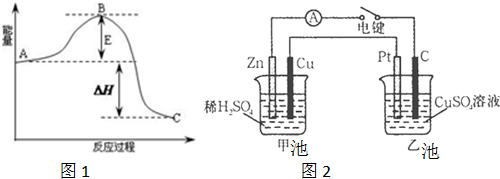
查看答案和解析>>
科目:高中化学 来源: 题型:
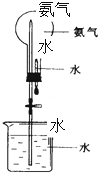 哈伯因为氨气的合成曾获1918年诺贝尔奖.
哈伯因为氨气的合成曾获1918年诺贝尔奖.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com