
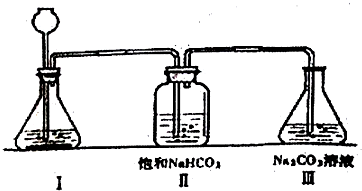
分析 ①根据制取二氧化碳的药品回答;
②用稀盐酸制取的二氧化碳中可能混有部分氯化氢气体,饱和的NaHCO3溶液与氯化氢气体可反应,除去氯化氢气体,防止进入Ⅲ与碳酸钠溶液反应,影响实验进行;
③由题意可知:氢氧化钙与碳酸钠溶液和碳酸氢钠溶液都能反应生成沉淀,现象相同,无法鉴别,所以选择氯化钙;根据是否生成气体和沉淀进行区分碳酸钠溶液和碳酸氢钠溶液;二氧化硫与二氧化碳类似.
解答 解:①制取二氧化碳可用药品是大理石与浓盐酸,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,
故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
②浓盐酸易挥发,用浓盐酸制取的二氧化碳中混有氯化氢气体,饱和的NaHCO3溶液与氯化氢气体可反应,除去氯化氢气体,防止进入Ⅲ与碳酸钠溶液反应,影响实验进行,
故答案为:除去CO2中混有的HCl 气体;
③由题意可知:氢氧化钙与碳酸钠溶液和碳酸氢钠溶液都能反应生成沉淀,所以选择氯化钙;
碳酸钠与氯化钙反应生成碳酸钙沉淀,题干信息可知碳酸氢钠与氯化钙溶液反应生成碳酸钙沉淀、氯化钠、水和二氧化碳,据题意可知:Na2CO3溶液与CO2发生了化学反应,碳酸钠溶液与二氧化碳和水反应生成碳酸氢钠,而碳酸氢钠与氯化钙反应生成碳酸钙沉淀、氯化钠、水和二氧化碳,因此若有沉淀和气体生成,说明二者反应,若未反应,则溶液依然是碳酸钠,与氯化钙反应生成沉淀;
由CaCO3+CO2+H2O=Ca(HCO3)2可知,Na2CO3溶液与CO2发生化学反应的化学方程式是:Na2CO3+CO2+H2O═2NaHCO3;依据此化学反应的规律,亚硫酸钠对应碳酸钠,二氧化硫对应二氧化碳,则亚硫酸钠溶液与二氧化硫反应方程式是:Na2SO3+SO2+H2O=2NaHSO3;
故答案为:CaCl2;有沉淀生成;既有气体又有沉淀生成;Na2CO3+CO2+H2O═2NaHCO3;Na2SO3+SO2+H2O=2NaHSO3.
点评 本题主要考查了物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确答案.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应 | |
| B. | CCl4分子的比例模型为  其空间构型为正四面体 其空间构型为正四面体 | |
| C. | 全降解塑料  可由环氧丙烷 可由环氧丙烷  和CO2缩聚制得 和CO2缩聚制得 | |
| D. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2,SiO2,P2O5 | B. | PCl3,CO2,H2SO4 | C. | SiC,H2O,NH3 | D. | HF,CO2,Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用高锰酸钾制取氧气 | |
| B. | 用氯酸钾和二氧化锰制取氧气 | |
| C. | 用锌和稀硫酸制取氢气 | |
| D. | 用石灰石和稀盐酸制取二氧化碳气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.2 mol•L-1 CH3COONa溶液中含有0.2NA个CH3COO- | |
| B. | 标准状况下,22.4 L CO2含有NA个碳氧双键 | |
| C. | 一定温度下,将2 mol SO2和1 mol O2充入装有催化剂的容器中发生反应,转移4NA个电子 | |
| D. | 1 mol羟基(-OH)中含9NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2XO2-在溶液中既可发生电离,又可发生水解 | |
| B. | c(H2XO2-)+c(HXO22-)+c(XO23-)+c(H3XO2)=0.01mol•L-1 | |
| C. | c(H+)=c(OH-)+c(H3XO2) | |
| D. | c(Na+)+c(H+)=c(OH-)+c(H2XO2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是动植物生长不可缺少的元素,含氮化合物也是重要的化工原料.自然界中存在如下氮的循环过程,工业上也可通过一系列的化学反应模拟该过程,实现氮的转化.
氮是动植物生长不可缺少的元素,含氮化合物也是重要的化工原料.自然界中存在如下氮的循环过程,工业上也可通过一系列的化学反应模拟该过程,实现氮的转化.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com