
分析 (1)化学键是构成物质的重要方式之一,特殊的物质不存在任何化学键,如Ar等单原子分子;离子化合物中可能含有共价键,共价化合物中一定不含离子键;
(2)同素异形体的概念:由同种元素组成的结构性质不同的单质;同位素的概念:质子数相同,中子数不同的同种元素的不同核素.
解答 解:(1)CO2和HCl中,C和O、H和Cl都是以共价键相结合,故只存在共价键的是②③;
K2S中,K+与S2-以离子键相结合,故只存在离子键的是⑤;
NaOH中,Na+与OH-以离子键相结合,O与H之间是共价键,故既存在共价键又存在离子键的是④;
Ar是单原子分子,不存在任何化学键,故不存在化学键的是①,
故答案为:②③;⑤;④;①;
(2)①H2O和D2O,都是由氢氧元素组成的水,属于同种物质;
②质子数相同都是6,中子数不同分别是6、7,互为同位素;
③是由氧元素组成的两种不同单质,互为同素异形体;
④是由H元素组成的同种单质;
故答案为:②;③.
点评 本题考查了同位素、同素异形体、同分异构体、同系物的概念本、对物质中的化学键的认识,并不是所有的物质都含有化学键,稀有气体中不含有任何化学键.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
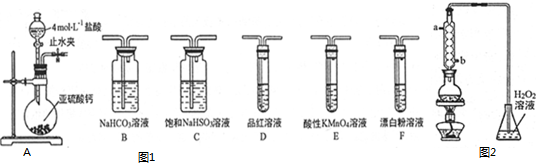
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
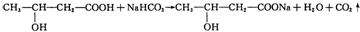 .
. .
.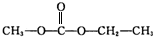 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢燃料电池汽车的使用可以有效减少城市空气污染 | |
| B. | 电解水制取氢气是理想而经济的制氢方法 | |
| C. | 发展氢燃料电池汽车不需要安全高效的储氢技术 | |
| D. | 氢燃料电池把氢气和氧气燃烧放出的热能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为: 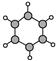 |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为: 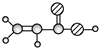 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,平衡常数不变 | |
| B. | 减小容器体积,正反应速率增大、逆反应速率减小 | |
| C. | 增大CO(NH2)2的量,CO2的转化率减小 | |
| D. | 降低温度,平衡向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com