
【题目】氟氧酸是较新颖的氧化剂,应用性极强,可用被氮气稀释的氟气在细冰上缓慢通过制得:F2+H2O=HOF+HF。该反应中水的作用与下列反应中水的作用相同的是
A.钠与水反应制氢气
B.过氧化钠与水反应制氧气
C.氯气与水反应制次氯酸
D.氟单质与水反应制氧气
科目:高中化学 来源: 题型:
【题目】下列四种情况不能用下图图像表示的是( )
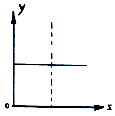
A.N2(g)+3H2(g)![]() 2NH3(g),恒容充入He,N2的转化率与时间的关系
2NH3(g),恒容充入He,N2的转化率与时间的关系
B.CH4(g)+H2O(g)![]() CO(g)+3H2(g);ΔH>0,平衡后CH4的物质的量与△H的关系
CO(g)+3H2(g);ΔH>0,平衡后CH4的物质的量与△H的关系
C.FeCl3+3KSCN![]() Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl—)与正反应速率关系
Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl—)与正反应速率关系
D.H2(g)+I2(g)![]() 2HI(g),平衡后缩小容器容积,速率与时间的关系
2HI(g),平衡后缩小容器容积,速率与时间的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,且可用来检验E的单质。
回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 。(填元素符号)
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示)。
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 。A、C形成化合物的电子式为 。
(4)D最高价氧化物的水化物的化学式为 。
(5)单质D在充足的单质E中燃烧,反应的化学物方程式为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 。
(6)单质E与水反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素又称黄碱,是我国特定的中药材麻黄中所含的一种生物碱.经我国科学工作者研究发现其结构如图:
①麻黄素中含氧官能团的名称是 ,属于 类(填“醇”或“酚”).
②下列各物质:

与麻黄素互为同分异构体的是 (填序号,下同), 互为同系物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属的叙述正确的是 ( )
A. 随着核电荷数增加,它们的密度逐渐减小
B. 随着核电荷数增加,单质的熔点、沸点升高
C. 随着核电荷数的增加,单质与水反应的剧烈程度增大
D. 随着核电荷数增加,离子的氧化性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性 KMnO4 溶液能与草酸(H2C2O4)溶液反应。某化学探究小组利用反应过程中溶液紫色消失快慢的 方法来研究影响反应速率的因素。
I.实验前首先用浓度为 0.1000 mol/L 酸性 KMnO4 标准溶液滴定未知浓度的草酸溶液。
(1)写出滴定过程中发生反应的离子方程式 。
(2)下列有关一定物质的量浓度溶液配制的说法中正确的是 。
A.把 15.8 g KMnO4 固体溶于 1 L 水中所得溶液物质的量浓度为 0.1 mol/L
B.把 0.01 mol KMnO4 固体投入 100 mL 容量瓶中加水至刻度线,充分振荡后,浓度为 0.1 mol/L
C.需要 90 mL 0.1 mol/L 的 KMnO4 溶液,应准确称量 KMnO4 固体 1 58 g
D.定容时仰视容量瓶颈刻度线读数,会使配制的溶液浓度偏高
II.通过滴定实验得到草酸溶液的浓度为 0.2000 mol/L。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为 8.00 mL)。
实验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾 溶液 | |
体积(mL) | 浓度(mol/L) | |||
1 | 25 | 0.5 | 4.00 | 0.1000 |
2 | 50 | 0.5 | 4.00 | 0.1000 |
3 | 25 | 0.5 | 4.00 | 0.0100 |
4 | 25 | 0 | 4.00 | 0.1000 |
(3)写出表中实验 1 和实验 2 的实验目的: 。
(4)该小组同学对实验 1 和实验 3 分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验 编号 | 溶液褪色所需时间 (min) | ||
第 1 次 | 第 2 次 | 第 3 次 | |
1 | 14.0 | 13.0 | 11.0 |
2 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“其他条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,甲同学改进了实验方案,请简述甲同学改进 的实验方案______________。
(5)该实验中使用的催化剂应选择 MnSO4 并非 MnCl2,原因可用离子方程式表示为________。
III.工业上可用软锰矿(主要成分为 MnO2)经下列生产过程制备高锰酸钾。
①由软锰矿提取得到 MnO2,然后在 MnO2、KOH 的熔融混合物中通入空气可制得锰酸钾(K2MnO4);
②向锰酸钾溶液中通入CO2可获得高锰酸钾。
(6)第①步生产过程中,在熔融混合物中通入空气时发生反应的化学方程式:______________。
(7)向锰酸钾溶液中通入CO2可获得高锰酸钾,该反应中氧化产物与还原产物的物质的量之比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目.
①化合物M和N的分子式都是C2H4Br2,M的核磁共振氢谱图如图所示,则M的结构简式为 ,请预测N的核磁共振氢谱上有 个峰.
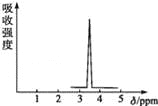
②用核磁共振氢谱的方法来研究C2H6O的结构,简要说明根据核磁共振氢谱来确定分子结构的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语错误的是 ( )
A.硫离子的核外电子排布式:1s22s22p6
B.碳原子的外围电子轨道表示式:![]()
C.碳﹣14的原子组成符号:![]() C
C
D.Cl﹣的结构示意图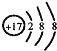
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com