
 对物质性质的认识源于对其结构的了解.
对物质性质的认识源于对其结构的了解. .
.分析 (1)①V元素原子核外电子数为23,位于第四周期ⅢB族;
②SO2分子中S原子的价层电子对数=2+$\frac{6-2×2}{2}$=3,杂化轨道数目为3;
③VO43-中价层电子对数为4,为正四面体结构;
(2)Si3N4晶体由硅原子和氮原子通过共价键作用而构成,晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大;
(3)根据原子半径和电荷分析,电荷越大、离子半径越小其熔点越高;
(4)氧化性指得到电子的能力,O2+为缺电子,O2-和O22-为得电子形成的微粒;
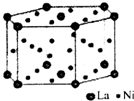
(5)根据均摊法计算晶胞中La、Ni原子数目,计算二者原子数目之比可得LaNinH4.5中n的值,再结合化学式计算晶胞中H原子数目,表示出晶胞中H原子总质量,再根据ρ=$\frac{m}{V}$计算氢在合金中的密度.
解答 解:(1)①V元素原子核外电子数为23,位于第四周期ⅢB族,基态价电子排布图为 ,
,
故答案为: ;
;
②SO2分子中S原子的价层电子对数=2+$\frac{6-2×2}{2}$=3,杂化轨道数目为3,S原子的杂化轨道类型为sp2杂化,
故答案为:sp2杂化;
③VO43-中价层电子对数为4,为正四面体结构,
故答案为:正四面体;
(2)Si3N4晶体由硅原子和氮原子通过共价键作用而构成,所以是原子晶体,晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′,
故答案为:原子晶体;>;
(3)电荷越大、离子半径越小其熔点越高,MgO晶体中离子的电荷数大于NaCl,离子间的平均距离小于NaCl,所以MgO晶体的晶格能高于NaCl晶体的晶格能,MgO晶体熔点高于NaCl晶体,
故答案为:高于;MgO晶体熔点高于NaCl晶体;
(4)氧化性指得到电子的能力,越缺电子,越易得到电子,O2+为缺电子,得电子能力最强,氧化性最强,O2-和O22-为得电子形成的微粒,氧化性弱,O2+、O2、O2-、O22-四种微粒所含的电子数逐渐增多,所以四种含氧微粒氧化性由强到弱的顺序为:O2+>O2>O2->O22-,
故答案安为:O2+;O2+缺电子;
(5)由图可知,晶胞中La原子数目为2×$\frac{1}{2}$+12×$\frac{1}{6}$=3,Ni原子数目为6+18×$\frac{1}{2}$=15,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),故1:n=3:15,则n=5,晶胞中H原子数目为4.5×3=13.5,晶胞体积为9.5×10-23cm3,氢在合金中的密度为$\frac{13.5}{6.02×10{\;}^{23}}$g÷8.5×10-23cm3=0.26g•cm-3,
故答案为:5;0.26g•cm-3.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化轨道与空间构型、价层电子对互斥理论、氢键、晶胞计算等,(5)中注意利用均摊法计算解答,难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
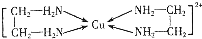 第四周期金属Cr、Fe、Cu在科学研究和工业生产中都有重要的用途.请回答下列问题:
第四周期金属Cr、Fe、Cu在科学研究和工业生产中都有重要的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 每生成0.2 mol O2,则被Fe2+还原的氧化剂为0.4 mol | |
| D. | 反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
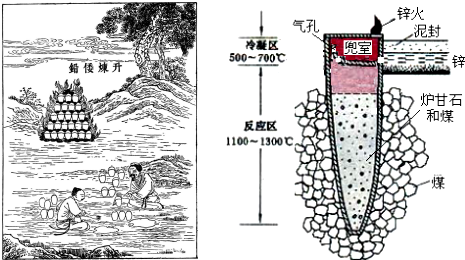
| A. | 升炼倭铅过程包含分解反应和氧化还原反应 | |
| B. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| C. | “泥封”的目的是为了防止得到的锌被氧化 | |
| D. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -824.4kJ•mol-1 | B. | -627.6kJ•mol-1 | C. | -744.7kJ•mol-1 | D. | -169.4kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铅蓄电池在充电过程中,正、负极质量都增大 | |
| B. | 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| C. | NH3•H2O溶液加水稀释后,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值减小 | |
| D. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
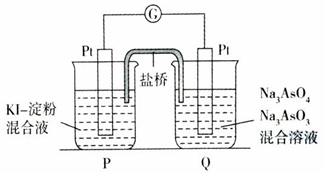
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com