
【题目】元素周期表中第三、四周期的某些元素在生产、生活中有着广泛的应用。
(1)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
①钒的价电子排布图是___________;
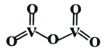
②V2O5是一种常见的催化剂,常用在SO2转化为SO3的反应中。V2O5的结构式如图所示,则V2O5分子中σ键和π键数目之比为____________;若将V2O5溶解在NaOH溶液中,可得到锐酸钠(Na3VO4),该盐中阴离子的立体构型为_____________,写出与VO43-空间构型相同的一种阳离子____________(填化学式)。
(2)氯化铝在有机化学中有很广泛的应用。无水氯化铝在177.8℃时升华,蒸气或熔融状态以Al2Cl6形式存在。下列关于氯化铝的推断错误的是_______。
a.氯化铝是分子晶体 b.Al2Cl6中Al是sp2杂化
c.氯化铝难溶于有机溶剂 d.Al2Cl6中存在配位键
(3)FeCO3可作补血剂,CoCO3可用于陶瓷工业的着色剂。已知:r(Fe2+)为61pm,r(Co2+)为65pmo在隔绝空气条件下分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是_________________________。
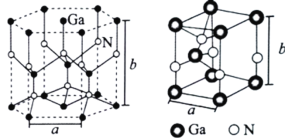
(4)GaN是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaN晶胞结构如图所示。已知六棱柱底边边长为acm,高为bcm,阿伏加德罗常数的值为NA。则晶胞中Ga原子采用的密堆积方式为______________,每个Ga原子周围距离最近的Ga原子数目为____;GaN的密度为_____________gem-3(用含a、b、NA的代数式表示)。
【答案】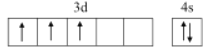 3:2 正四面体 NH4+ bc r(Fe2+)<r(Co2+),晶格能FeO>CoO,FeCO3比CoCO3易分解 六方最密堆积方式 12
3:2 正四面体 NH4+ bc r(Fe2+)<r(Co2+),晶格能FeO>CoO,FeCO3比CoCO3易分解 六方最密堆积方式 12 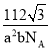
【解析】
(1)①钒是23号元素,外围5个电子排布于3d、4s轨道上,价电子排布式为3d34s2;
②根据图1可知,V2O5分子中含有6个σ键和4个π键;VO43-中V原子的价层电子对数=4+![]() =4,无孤电子对,VSEPR模型为正四面体;
=4,无孤电子对,VSEPR模型为正四面体;
(2)根据氯化铝的熔点确定其晶体类型,熔点较低的化合物一般为分子晶体,二聚物Al2Cl6中Al有4个Al-Cl键、含有配位键,氯化铝是非极性分子、易溶于有机溶剂;
(3)不溶性碳酸盐分解的过程实质是金属阳离子与碳酸根中的氧离子结合的过程,金属阳离子半径越小、与氧离子形成的离子键越强,碳酸盐分解的温度越低;
(4)Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为12;晶胞中Ga原子数为1+4×![]() +4×
+4×![]() =2,N原子数为1+2×
=2,N原子数为1+2×![]() +2×
+2×![]() =2,晶胞的质量m=
=2,晶胞的质量m=![]() g,根据密度公式计算晶体密度。
g,根据密度公式计算晶体密度。
(1)①钒是23号元素,核外有23个电子,价电子排布式为3d34s2,价电子排布图是![]() ;
;
②根据图1可知,V2O5分子中含有4个V=O双键和2个VO单键,一个双键含有1个σ键和1个π键,单键均为σ键,所以V2O5分子中含有6个σ键和4个π键,σ键和π键数目之比为3:2; VO43-中V原子的价层电子对数=4+![]() =4,无孤电子对,VSEPR模型和空间构型均为正四面体,所以与VO43-空间构型相同的一种阳离子为NH4+;
=4,无孤电子对,VSEPR模型和空间构型均为正四面体,所以与VO43-空间构型相同的一种阳离子为NH4+;
(2)a.氯化铝熔点较低,所以为分子晶体,故a正确;
b.Al的价层电子对数为4,采用sp3杂化,故b错误;
c.氯化铝是非极性分子、易溶于水和有机溶剂,故c错误;
d.蒸气或熔融状态以Al2Cl6形式存在,氯化铝中铝原子最外层电子只有3个电子,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供,所以含有配位键,故d正确;
故答案为:bc;
(3)不溶性碳酸盐分解的过程实质是金属阳离子与碳酸根中的氧离子结合的过程,金属阳离子半径越小,形成的氧化物晶格能越大、物质越稳定,由于r(Fe2+)<r(Co2+),所以FeCO3的分解温度低于CoCO3;
(4)晶胞图中Ga原子采用六方最密堆积方式,以结构单元上底面面心的Ga原子研究,上底面6个顶点Ga原子、内部的3个Ga原子之距离最近且相等,与上底面共面的结构单元内还有3个Ga原子,故每个Ga原子周围距离最近的Ga原子数目为12;晶胞中Ga原子数为1+4×![]() +4×
+4×![]() =2,N原子数为1+2×
=2,N原子数为1+2×![]() +2×
+2×![]() =2,晶胞的质量m=
=2,晶胞的质量m=![]() g,晶胞体积V=2×
g,晶胞体积V=2×![]() sin60a2bcm3=
sin60a2bcm3=![]() a2bcm3,晶体密度ρ=
a2bcm3,晶体密度ρ=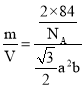 gcm3=
gcm3=![]() g/cm3。
g/cm3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3 和NaHCO3的说法错误的是
A. 等质量Na2CO3 和NaHCO3分别和足量盐酸反应,相同条件下前者生成CO2少
B. 将石灰水分别加入NaHCO3和Na2CO3中,前者不生成沉淀
C. 相同条件下Na2CO3 比NaHCO3更易溶于水
D. Na2CO3 固体中含少量NaHCO3,可用加热法除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制250 mL 0.200 mol/L NaCl溶液,下列操作导致所配溶液浓度偏高的是( )
A.容量瓶洗净后未干燥B.移液后烧杯未洗涤
C.定容时俯视读数D.摇匀后液面低于刻度线再滴加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式_____________ ;
(2)用如图所示装置可检验木炭和浓硫酸反应产生的混合气体中含有SO2和CO2。
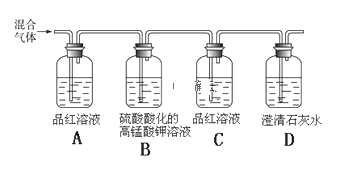
①能够证明混合气体中含有SO2的实验现象是:________________________________;
②设计B、C的实验目的是:________________________________________________;
③写出B中发生反应的离子方程式:_____________________________;
④能够证明混合气体中含有CO2的实验现象是:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔(H)属于一线降压药,是当前治疗高血压、冠心病、心绞痛、慢性心力衰竭等心血管疾病的常用药物之一,它的一种合成路线:

已知:CH3COCH2R![]() CH3CH2CH2R
CH3CH2CH2R
回答下列问题:
(1)A物质是一种芳香化合物,其化学名称是_________________。
(2)反应B→C的化学方程式为___________;C→D的反应类型为.____________。
(3)D中所含官能团的名称是________________.
(4)G的分子式为________________;已知碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子,则H(美托洛尔)中含有____________个手性碳原子。
(5)芳香族化合物X与C互为同分异构体。写出同时满足下列条件的X的一种结构简式__________________。
①能发生银镜反应;
②不与FeCl3发生显色反应;
③含“C-C1”键;
④核磁共振氢谱有4个峰,峰面积比为2:2:2:1.
(6)4-苄基苯酚(![]() )是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:___________________(无机试剂任选)。
)是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:___________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用18.4molL-1的浓硫酸来配制480mL0.2molL-1的稀硫酸。可供选用的仪器有:①胶头滴管②烧瓶③烧杯④药匙⑤量筒⑥托盘天平⑦玻璃棒
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有___(选填序号),还缺少的仪器有(写仪器名称)___。
(2)需要用量筒量取上述浓硫酸的体积为___mL,量取浓硫酸时应选用___(选填①10mL②50mL③100mL)规格的量筒。
(3)实验中两次用到玻璃棒,其作用分别是:___、___。
(4)下列对容量瓶及其使用方法的描述中正确的是___。
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后,必须烘干
C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2cm处,改用胶头滴管加蒸馏水至刻度线
D.使用前要检查容量瓶是否漏水
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有___(填序号)
①未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知磷酸分子(![]() )中的三个氢原子都可与重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。则下列说法正确的是
)中的三个氢原子都可与重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。则下列说法正确的是
A.H3PO2在水溶液中发生电离:H3PO2![]() H++H2PO2-、H2PO2-
H++H2PO2-、H2PO2-![]() H++HPO22-
H++HPO22-
B.H3PO4属于三元酸、H3PO2属于二元酸
C.NaH2PO2属于酸式盐,其水溶液呈酸性
D.H3PO2具有较强的还原性,其结构式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组试利用镁铝合金废料(不含其它杂质)制备硫酸铝晶体,其实验流程如图:
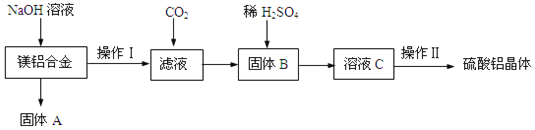
(1)在镁铝合金中加入NaOH溶液,发生反应的离子反应方程式为_____,固体B的化学式_____。
(2)操作Ⅱ包含的实验步骤有:_____、冷却结晶、过滤、洗涤、干燥。
(3)若初始时称取的镁铝合金废料的质量为7.65 g,得到固体A的质量为3.6 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%)。计算所得硫酸铝晶体的化学式为_____。( 在答题卷上写出计算过程)
(4)另取7.65 g该镁铝合金废料溶于400mL 3mol/L盐酸后,滴入3mol/LNaOH溶液,使所得沉淀中的Al(OH)3完全溶解,则滴入NaOH溶液的体积最少为_____mL(在答题卷上写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com