
����Ŀ��ijС��ͬѧΪ�Ƚ�����������ClO����SO42-��Fe3+��������ǿ�����������ʵ��(�г���������)��
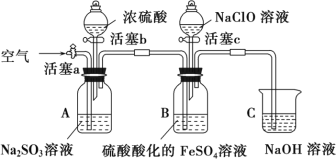
ʵ�鲽�輰�����¼���£�
��������c����װ��B�μӴ���������Һ����Һ������Ϊ��ɫ��һ��ʱ���۲쵽װ��B��Һ���Ϸ����ֻ���ɫ����ʱ�������رջ��� c��
����ע����ȡ������װ��B�е���Һ���μӼ���KSCN��Һ����Һ��ΪѪ��ɫ��
��������b����װ��A�м�������Ũ����رջ���b��װ��A�в������壬װ��B�������ݣ�һ��ʱ��۲쵽װ��B����Һ��ɫ��dz��ɫ��
����һ��ʱ�����ע����ȡ������װ�� B �е��ϲ���Һ��
����������a��ͨһ��ʱ�������
��ش��������⣺
��1��������ҩƷǰ����еIJ�����__________________________��
��2��������У�һ��ʱ���۲쵽װ��B��Һ���Ϸ����ֻ���ɫ��������ӷ���ʽΪ____________��
��3�������������ʼһ��ʱ����װ��B����Һ����ɫ�������Ա仯���˶�ʱ������Һ�з�����Ӧ�����ӷ���ʽΪ____________��
��4����������Ϊ����֤����Һ�д��ڵ�Fe2+���벹�������ò�������IJ�����ʵ������_______��
��5����������Ŀ��Ϊ______________��
��6������ʵ�����ɵó���ʵ��Ľ�����_____________��
���𰸡����װ��������![]() SO2��Cl2��2H2O=4H+��SO42����2Cl���μ� K3[Fe(CN)6]��Һ��������ɫ������װ���в�����SO2��Cl2����װ��C�У���NaOH��Һ���գ���ֹ��Ⱦ���������£������ԣ�ClO��>Fe3+>SO42-
SO2��Cl2��2H2O=4H+��SO42����2Cl���μ� K3[Fe(CN)6]��Һ��������ɫ������װ���в�����SO2��Cl2����װ��C�У���NaOH��Һ���գ���ֹ��Ⱦ���������£������ԣ�ClO��>Fe3+>SO42-
��������
��1�������Ʊ������ʵ�ʵ�飬��Ҫ����װ��������������c����װ��B�μӴ���������Һ����Һ������Ϊ��ɫ��˵��Fe2+��ClO-����ΪFe3+��ClO-����ԭΪCl-��һ��ʱ���۲쵽װ��B��Һ���Ϸ����ֻ���ɫ����ʱ��˵��Cl-��ClO-����Ϊ��������3�������������ʼһ��ʱ����װ��B����Һ����ɫ�������Ա仯��˵����ʼFe3+û��Ӧ��������SO2����������ԭ��Ӧ��һ��ʱ��۲쵽װ��B����Һ��ɫ��dz��ɫ��˵��Fe3+��SO2����ΪSO42-����4��Fe2+��K3[Fe(CN)6]��Һ��������ɫ��������5��SO2��Cl2�ж�����Ⱦ��������6�������������������Դ�����������������Իش���
��1����ʵ���漰��������������Ʊ���ʵ��������ҩƷǰ����еIJ����Ǽ��װ������������2��������У�һ��ʱ���۲쵽װ��B��Һ���Ϸ�����������˵��Cl����ClO������Ϊ��������Ӧ�����ӷ���ʽΪ![]() ����3�������������ʼһ��ʱ����װ��B����Һ����ɫ�������Ա仯��˵��Fe3+û��Ӧ��������SO2����������ԭ��Ӧ����Ӧ���ӷ���ʽ��SO2��Cl2��2H2O=4H+��SO42-��2Cl-����4����֤����Һ�д���Fe2+�ķ���������ע����ȡ�����ϲ���Һ�еμ� K3[Fe(CN)6]��Һ��������ɫ����������Fe2+����5��������a��ͨһ��ʱ�������Ŀ���ǽ�װ���в�����SO2��Cl2����װ��C�У���NaOH��Һ���գ���ֹ��Ⱦ����6����װ��B�μӴ���������Һ����Һ������Ϊ��ɫ��˵��Fe2+��ClO������ΪFe3+��˵��������ClO->Fe3+��һ��ʱ��۲쵽װ��B����Һ��ɫ��dz��ɫ��˵��Fe3+��SO2����ΪSO42-��������Fe3+>SO42-�����Կɵó���ʵ��Ľ��������������£������ԣ�ClO->Fe3+>SO42-��
����3�������������ʼһ��ʱ����װ��B����Һ����ɫ�������Ա仯��˵��Fe3+û��Ӧ��������SO2����������ԭ��Ӧ����Ӧ���ӷ���ʽ��SO2��Cl2��2H2O=4H+��SO42-��2Cl-����4����֤����Һ�д���Fe2+�ķ���������ע����ȡ�����ϲ���Һ�еμ� K3[Fe(CN)6]��Һ��������ɫ����������Fe2+����5��������a��ͨһ��ʱ�������Ŀ���ǽ�װ���в�����SO2��Cl2����װ��C�У���NaOH��Һ���գ���ֹ��Ⱦ����6����װ��B�μӴ���������Һ����Һ������Ϊ��ɫ��˵��Fe2+��ClO������ΪFe3+��˵��������ClO->Fe3+��һ��ʱ��۲쵽װ��B����Һ��ɫ��dz��ɫ��˵��Fe3+��SO2����ΪSO42-��������Fe3+>SO42-�����Կɵó���ʵ��Ľ��������������£������ԣ�ClO->Fe3+>SO42-��


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ʳ��������Ա仯���ɵĸ���ԭ����
A.ԭ�ӵ��Ӳ�������B.Ԫ�صĻ��ϼ۳��������Ա仯
C.��������Ų����������Ա仯D.�˵������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2A + B![]() 3C + 4D ��Ӧ��(�����ʾ�Ϊ����)����ʾ�÷�Ӧ�����������
3C + 4D ��Ӧ��(�����ʾ�Ϊ����)����ʾ�÷�Ӧ�����������
A. v(A)= 0.5 mol��L��1��s��1
B. v(B)= 0.3 mol��L��1��s��1
C. v(C)= 0.8 mol��L��1��s��1
D. v(D)= 30 mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ���������������������������
��1��Aѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������200mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼���£��ۼ�ֵ����
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
���������mL������״���� | 100 | 240 | 688 | 810 | 860 |
�ٷ�Ӧ��������ʱ����ǣ���0��1��1��2��2��3��3��4��4��5 ��_____ min��ԭ����_____________��
����2��3minʱ����������Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_________��������Һ������䣩
��2��Bѧ��Ҳ��ͬ����ʵ�飬�����ڷ�Ӧ̫�죬�ⲻ�������������취���ͷ�Ӧ���ʣ��������ѡ���������м�������___________�Լ�����Ӧ���ʡ�����д���ţ�
A������ B��HNO3��Һ C��CuSO4��Һ
��3��ij�¶�����10L�ܱ������У�3����̬���ʣ�A��B��C�����ʵ�����ʱ��仯������ͼ��

�ٸ÷�Ӧ�Ļ�ѧ����ʽ��___________
���ڸ������ﵽ��Ӧ���ȣ�ƽ��״̬��ʱ��Ӧ���ת����Ϊ____________
��ת����=��ת�������ʵ���/��ʼ���ʵ�������100%��(����������1λС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�����������ֽ������ֱ���������ͬ���ͬŨ�ȵ����ᷴӦ��ͬ��ͬѹ�£�������ͬ�������������Ӧ��( )
A. ����ʧȥ������Ŀ��� B. ���Ľ������������
C. ���Ľ��������ʵ������ D. ���ĵ�HCl���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������״����Ͻ�TiNi�����㷺�����������Ǻ�����ɴ������ߣ����ٴ�ҽ��������Ҳ���й㷺��Ӧ�á��ش��������⣺
(1)д����̬Tiԭ�ӵĵ����Ų�ʽ:_________��Ni��Ԫ�����ڱ��е�λ����_________��
(2)�����Ͻ��������ȵ���������Ti(SO4)2��NiSO4�����������ӵ����幹��Ϊ______������ԭ�ӵĹ���ӻ�������_______��
(3)����ͬ���ڵ���һ��Ԫ����(Co)���γɷ���ʽ��ΪCo(NH3)5BrSO4��������������һ�ֻ�ѧʽΪ[Co(NH3)5Br]SO4��������Һ�м�BaCl2��Һʱ��������____________������һ����������Һ�м���BaCl2��Һʱ������������������AgNO3��Һʱ����������ɫ��������ڶ��������Ļ�ѧʽΪ _______________ ��
(4)һ�������Ͻ�����������ṹ��ͼ��ʾ:

�ٸúϽ���Ti����λ��Ϊ________��
�����Ͻ���ܶ�Ϊd g/cm3�������߳�a=________pm�����ú�d�ļ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҺpH��1������Һ�п��ܺ���Fe3+��NO3����I����Cl���е�һ�ֻ��֣������Һ�е�����ˮ�������屻��ԭ���ɴ��ƶϸ���Һ�У� ��
A.��Fe3+��NO3������I����Cl��
B.��I��������Fe3+��NO3����������Cl��
C.��NO3��������Fe3+��I����������Cl��
D.��I����Fe3+������Cl����������NO3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com