
物质 R2CO3的饱和溶液 V mL,密度为ρ g·cm-3,c(R+) =" P" mol·L-1,溶质的质量分数为 a% ,溶质的式量为 M 。则下 列表达式正确的是( )
列表达式正确的是( )
科目:高中化学 来源: 题型:
A、a=
| ||
B、s=
| ||
C、P=
| ||
D、V×ρ×a%=
|
查看答案和解析>>
科目:高中化学 来源:江苏省某重点中学2011-2012学年高一上学期开学考试化学试题 题型:013
|
固体物质W在水、乙醇两种溶剂中的溶解度随温度变化的曲线如图所示.下列说法错误的是
| |
| [ ] | |
A. |
物质W能溶解在水和乙醇中 |
B. |
t1℃时,物质w在水中的溶解度为mg |
C. |
t2℃时,物质W在水中与在乙醇中的溶解度相同 |
D. |
将t1℃时物质w的饱和水溶液升温至t2℃有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:058
20℃时,在100g水中溶解11.1g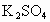 恰好达到饱好,此饱和溶渡的密度为
恰好达到饱好,此饱和溶渡的密度为 .将350mL此温度下的
.将350mL此温度下的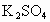 饱和溶注解用水稀释至500mL.计算稀释后溶液中
饱和溶注解用水稀释至500mL.计算稀释后溶液中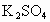 的质量分数和溶注解中
的质量分数和溶注解中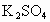 的物质的量浓度.(稀溶液密度
的物质的量浓度.(稀溶液密度 )
)
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
20℃时,在100g水中溶解11.1g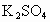 恰好达到饱好,此饱和溶渡的密度为
恰好达到饱好,此饱和溶渡的密度为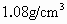 .将350mL此温度下的
.将350mL此温度下的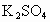 饱和溶注解用水稀释至500mL.计算稀释后溶液中
饱和溶注解用水稀释至500mL.计算稀释后溶液中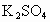 的质量分数和溶注解中
的质量分数和溶注解中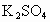 的物质的量浓度.(稀溶液密度
的物质的量浓度.(稀溶液密度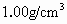 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(08六都中学模拟)(13分)某学校化学兴趣小组同学在两支小试管中分别加入浓度为4mol/L稀盐酸3mL,将分别装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒人试管中,观察到的现象及分析如下:
(1)比较两支试管中的现象: 。
(2)若两气球内的压强相同.两试管大小相同,则大小气球体积之比约为 (填最简整数比)
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+H+(aq)=H2O(1)+CO2(g);△H>O;
CO32-(aq)+2H+(aq)=H2O(1)+CO2(g);△H<O;
甲分析结论的方法是否科学? 。(填“是”或“否”)
(4)为研究反应是吸热还是放热,乙同学继续进行下列实验。(每个实验平行做三次,取平均值)
序 号 | 试剂l | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
1 | 35mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
2 | 35mL水 | 3.2gNa2CO3固体 | 20℃ | 24.3℃ |
3 | 35mL稀盐酸 | 含2.5g NaHCO3 的饱和溶液32.5ml | 20℃ | 19℃ |
4 | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶23.1mL+10mL水 | 20℃ | 24.2℃ |
5 | 35mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
6 | 35mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
①该研究报告的题目是《 》
②通过上述实验可得出五条结论:
a.NaHCO3的溶解是 (“吸热”或“放热”)过程;
b.Na2CO3的溶解是 (“吸热”或“放热”)过程;
c.NaHCO3的饱和溶液和盐酸的反应是 (”吸热”或“放热”)反应;
d.Na2CO3的饱和溶液和盐酸的反应是 (“吸热”或“放热”)反应;
e.NaHCO3固体与稀盐酸反应的反应热是 (填a→d的字母)的热效应之和。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com