
分析 氧化还原反应方程式配平方法:分析方程式中各元素化合价变化,依据氧化还原反应化合价升降数目相等结合原子个数守恒配平方程式,据此解答.
解答 解:二氧化硫与高锰酸根离子反应中,+4价硫化合价升高为硫酸根离子中+6价,化合价升高2,高锰酸根中+7价锰降为锰离子中+2价,化合价降5,要使化合价升降数目相等,则二氧化硫系数为5,高锰酸根系数为2,依据原子个数守恒方程式:5SO2+2MnO4_+2H2O=5SO42_+2Mn2++4H+;
故答案为:5 2 2 5 2 4;
硝酸铵分解生成硝酸氮气和水反应中,铵根离子中-3价氮被氧化生成氮气中0价,硝酸根离子中+5价的氮降为氮气中0价,要使得失电子守恒,则有5mol铵根离子被氧化同时有2mol硝酸根离子被还原,硝酸铵系数为5,硝酸系数为2,氮气系数为4,依据原子个数守恒,方程式:N5H4NO3=2HNO3+4N2↑+9H2O;
故答案为:5 2 4 9.
点评 本题考查了氧化还原反应方程式配平,准确判断元素化合价升降数目,依据氧化还原反应得失电子守恒即可解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | F2和Br2的沸点 | |
| B. | H-和Be2+的离子半径 | |
| C. | 同温下分别在100g水中最多能溶解的无水CuSO4的质量和CuSO4•5H2O的质量 | |
| D. | 在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量燃烧化石燃料是造成雾霾的一种重要因素 | |
| B. | 食品中的抗氧化剂本身是难于氧化的物质 | |
| C. | 含SO42-的澄清溶液中不会含Ba2+ | |
| D. | 凡溶于水能电离出H+离子的化合物均属于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X氢化物溶于水后,在常温下,该溶液的pH<7 | |
| B. | Y的最高价氧化物的水化物具有两性 | |
| C. | Z离子在水溶液中水解导致其溶液显碱性 | |
| D. | 简单离子的半径:Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
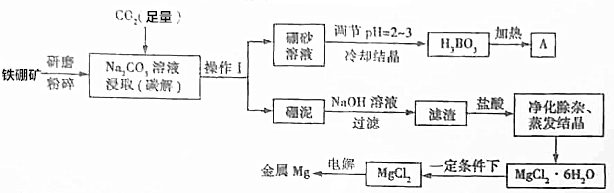
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com