
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
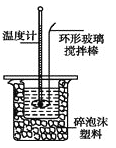
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_____________。大烧杯如不盖硬纸板,求得的中和热数值将 (填“偏大”、“偏小”或“无影响”)。结合日常生活实际该实验在 中(家用产品)效果更好。
(3)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(4)取50 mLNaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
试验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①表中的温度差平均值为 ℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c = 4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④实验中改用60mL0.5mol/L盐酸跟50mL0.55 mol·L-1氢氧化钠进行反应,与上述实验相比,所放出的热量 (填相等或不相等,下同),所求的中和热无偏差时 简述理由 。
【答案】I(1)5.0(2)abe
Ⅱ(1)Cu传热快,热量损失大;(2)提高装置的保温效果;偏小;保温杯;
(3)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l)ΔH=-57.3kJ/mol
(4)①4.0②53.5kJ/mol③acd④不相等;相等;中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,与酸碱用量无关。
【解析】
试题分析:Ⅰ、(1)若实验中大约要使用245mLNaOH溶液,应选择250mL的容量瓶,则至少需要称量NaOH固体质量为40g/mol×0.50mol/L×0.25L=5.0g;
(2)氢氧化钠要在小烧杯中称量,称量固体氢氧化钠所用的仪器有天平、烧杯和药匙,答案为abe;
Ⅱ、(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝搅拌棒是热的良导体,Cu传热快,热量损失大;
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果;大烧杯如不盖硬纸板,会造成热量散失,使求得的中和热数值偏小;在日常生活中,该实验在保温杯中进行效果更好。
(3)因为中和热为57.3 kJ·mol-1,根据中和热的定义,该反应中和热的热化学方程式为1/2H2SO4(aq)+ NaOH(aq )=1/2Na2SO4(aq)+ H2O(l)ΔH=-57.3kJ/mol。
(4)①第一次测定温度差为:(29.6-26.1)℃=3.5℃,第二次测定的温度差为:(31.2-27.2)℃=4.0℃,第三次测定的温度差为:(29.8-25.9)℃=3.9℃,第三次测定的温度差为:(30.4-26.3)℃=4.1℃,实验1的误差太大要舍去,三次温度差的平均值为4.0℃。
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80mL×1g/cm3=100g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为:Q=mc△T=80g×4.18J/(g℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-1.3376kJ÷0.025mol=-53.5kJ/mol。
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,a项正确;b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,b项错误;c。分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,c项正确;d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,测得温度偏低,中和热的数值偏小,d项正确;答案选acd。
(4)实验中改用60mL0.5mol/L盐酸跟50mL0.55 mol·L-1氢氧化钠进行反应,生成水的物质的量增多,所以与上述实验相比,所放出的热量不相等;中和热是指强酸、强碱的稀溶液发生反应生成1mol水时放出的热量,所以所求的中和热无偏差时相等。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】现有0.270 kg 质量分数为10 %的CuCl2溶液。计算:
(1)溶液中Cu2+ 和Cl-物质的量。
(2)若该溶液密度为1.08 g/mL,则CuCl2的物质的量浓度是多少?
(3)若取该溶液100 mL,加入铁片(过量),充分反应后对铁片洗涤、烘干、称重,铁片质量增加多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应 a A(g)![]() b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( )
b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( )
A. 平衡向正反应方向移动了
B. 物质A的转化率减少了
C. 物质B的质量分数增加了
D. a<b+c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式,书写正确的是( )
A.FeCl3═Fe3++Cl3﹣
B.NaHCO3═Na++H++CO32﹣
C.Al2(SO4)3═2Al3++3SO42﹣
D.KMnO4═K++Mn7++4O2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
①维生素C具有还原性,在人体内起抗氧化作用
②NO2溶于水时发生氧化还原反应
③1 mol Cl2参加反应转移电子数一定为2NA
④阴离子都只有还原性
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当物质的下列物理量不再发生变化时,表明反应A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
A.混合气体的密度 B.混合气体的总物质的量
C.混合气体的压强 D.混合气体的总体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)一定温度下,在2L的密闭容器中,SO2、O2、SO3三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题:
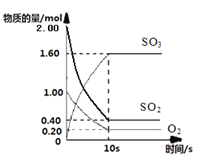
①反应的化学方程式为
②反应开始到10s,用SO2表示的反应速率为
③O2的平衡转化率为
(2)对于反应:2SO2(g)+O2(g)![]() 2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
(3)已知:2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6kJ·mol-1
2SO3(g)ΔH=-196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g)ΔH=-113.0kJ·mol-1
2NO2(g)ΔH=-113.0kJ·mol-1
则反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH=_________kJ·mol-1。
SO3(g)+NO(g)的ΔH=_________kJ·mol-1。
(4)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_________
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1 mol SO3的同时生成1 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物甲经氧化后得到乙(分子式为C2H3O2Cl);而甲经水解可得到丙,1mol丙和2mol乙反应得到一种含氯的酯(C6H8O4Cl2)由此推断甲的结构简式为
A. Cl-CH2-CH2-OH B. HCOOCH2Cl
C. Cl-CH2-CHO D. HO-CH2-CH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com