
下列有关物质的性质或应用的说法正确的是
A.晶体硅具有半导体性质,可用于生成光导纤维
B.用Na2O2漂白过的织物、麦秆日久又渐渐变成黄色
C.K2FeO4具有强氧化性,可用于自来水的杀菌消毒、
D.浓硫酸具有较强酸性,常用作淀粉水解的催化剂
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ③⑤⑥ | C. | ②③⑥ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是
A.在0.1mol·L-1Na2S溶液中:2c(Na+)>c(S2-)>c(HS-)>c(OH-)
B.一定量的(NH4)2SO4与NH3·H2O混合所得的酸性溶液中:c(NH4+)<2c(SO42-)
C.向0.1mol·L-1盐酸与0.1mol·L-1K2CO3溶液等体积混合:
c(K+)>c(Cl-)>c(OH-)>c(HCO3-)>c(H+)
D.向0.1mol·L-1Na2CO3溶液和0.1mol·L-1NaHCO3溶液等体积混合:
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
在100℃时,将0.40mol二氧化氮气体充入2L密闭容器中,每隔一段时间对该容器内的得到数据如下
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法中正确的是
A.反应开始20s内以二氧化氮表示的平均反应速率为0.00125mol·L-1·s-
B.80s时混合气体的颜色与60s时相同,比40s时的颜色深
C.80s时向容器中加入0.32mol氦气,同时将容器扩大为4L,则平衡将不移动
D.若起始投料为0.20molN2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
工业上曾经通过反应“3Fe+4NaOH Fe3O4+2H2↑十4Na↑;”生产金属钠。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑;”生产金属钠。下列有关说法正确的是
A.用磁铁可以将Fe与Fe3O4分离
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.每生成1molH2,转移的电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2 的体积分数是80%
的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,8 g O2含有4nA个电子
B.1 L 0.1 mol·L-1的氨水中有nA个NH
C.标准状况下,22.4 L盐酸含有nA个HCl分子
D.1 mol Na被完全氧化生成Na2O2,失去2nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
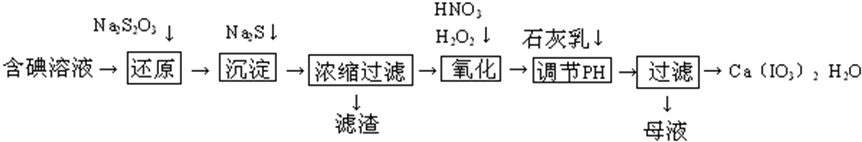
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com