
| A. | Cl2 | B. | O2 | C. | SO2 | D. | NH3 |
科目:高中化学 来源: 题型:实验题
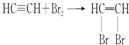
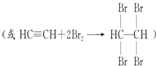 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | |
| 电离能(kJ•mol-1) | 578 | 1 817 | 2 745 | 11 578 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 氨水物质的量浓度/ (mol•L-1) | 盐酸物质的量浓度/ (mol•L-1) | 混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
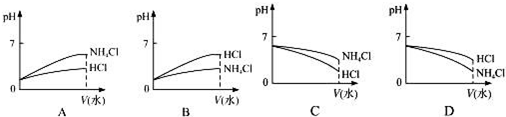
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲装置中电能转化为化学能 | B. | 乙装置中电能转化为化学能 | ||
| C. | 乙装置中铜片表面有气泡生成 | D. | 甲装置中铜片表面有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23gNa在氧气中完全燃烧失去NA个电子 | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.2 NA | |
| C. | 标准状况下,22.4LH2O含有NA个分子 | |
| D. | 1L0.5 mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
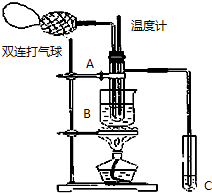 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com