
| A. | 铜为正极,发生氧化反应 | B. | 锌为负极,被氧化 | ||
| C. | 用酒精替代稀硫酸电池会正常工作 | D. | 电池放电后,溶液变为蓝色 |
科目:高中化学 来源: 题型:选择题
| A. | 中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 | |
| B. | 准确测量中和热的实验过程中,至少需测定温度4次 | |
| C. | 表示中和热的热化学方程式:H+(l)+OH-(l)═H2O(l)△H=-57.3 kJ/mol | |
| D. | 已知2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol,则该反应的中和热为114.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
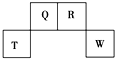 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等.请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等.请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论 |
1向盛放溶液的试管中加入足量HNO3. | 有气泡产生 | 证明有CO32-. |
2继续向试管中加入足量Ba(NO3)2溶液 | 有白色沉淀生成 | 证明有SO42-. |
3过滤,向滤液中加适量的AgNO3溶液 | 有白色沉淀生成 | 证明有Cl-. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5Cl2+I2+6H2O═10HCl+2HIO3 | |
| B. | 2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| C. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | HCl+NaOH═NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
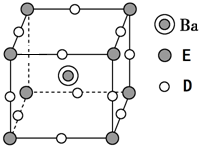 有原子序数依次增大的A、B、C、D、E、F、G 七种元素,A 是短周期中族序数等于周期数的非金属元素;B 元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;D 的最外层电子数与电子层数之比为3:1;E是地壳中含量第二多的非金属元素;D、F同族; G 元素原子序数为24.
有原子序数依次增大的A、B、C、D、E、F、G 七种元素,A 是短周期中族序数等于周期数的非金属元素;B 元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;D 的最外层电子数与电子层数之比为3:1;E是地壳中含量第二多的非金属元素;D、F同族; G 元素原子序数为24.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 所用试剂 | 操作方法 |
| ① | 乙烯 | 二氧化硫 | KMnO4溶液 | 洗气 |
| ② | 乙炔 | 硫化氢 | 氢氧化钠溶液 | 洗气 |
| ③ | 苯 | 甲苯 | 溴水 | 分液 |
| ④ | 溴苯 | 液溴 | 氢氧化钠溶液 | 分液 |
| A. | ②③ | B. | ①④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 | |
| B. | 当一个可逆反应达到平衡状态时,正反应速率和逆反应速率相等,都等于0 | |
| C. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com