
【题目】依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如下图所示。
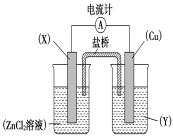
请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是__________________。
(2)铜电极为电池的________极,发生的电极反应为_______________________ X极上发生的电极反应为______________。
(3)外电路中的电子是从________极流向__________极(填名称)。
(4)盐桥中的Cl-向________极移动,如将盐桥撤掉,电流计的指针将________偏转。
【答案】Zn CuSO4溶液或CuCl2溶液 正极 Cu2++2e-=Cu Zn-2e-=Zn2+ 锌 铜 锌 不
【解析】
原电池中存在一个自发进行的氧化还原反应,Zn的化合价升高,作负极,即图中X为锌,铜作正极,其电极反应式为Cu2++2e-=Cu,X电极为负极,失电子,其电极反应式为Zn-2e-=Zn2+。
(1)由Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)反应可知,锌的化合价升高,被氧化,作负极,铜为正极,则电解质溶液为氯化铜或硫酸铜;
(2)铜为正极,是溶液中的铜离子得到电子,电极反应为:Cu2++2e-=Cu,锌为负极,失去电子生成锌离子,电极反应为Zn—2e-=Zn2+;
(3)原电池工作时,电子从负极经过导线流向正极,所以从Zn流向Cu;
(4)原电池工作时,阴离子向负极移动,即向Zn极移动,若将盐桥撤掉,则不能形成闭合回路,电流计的指针不能偏转。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:
【题目】下列描述不正确的是( ).
A.在滴有酚酞的 Na2CO3溶液中慢慢滴入BaCl2溶液至过量,溶液的红色褪去
B.往Na2CO3溶液中加水,![]() 增大
增大
C.pH相同的①NH4Cl、②NH4Al (SO4)2、③NH4HSO4三种溶液中c(NH4+):①>②>③
D.在水电离出的c(H+)=1×10-12 mol/L的溶液中,Al3+一定不可能大量存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨水是氨气的水溶液,主要用作化肥。现有25℃时0.1 mol/L的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中的c(NH4+)_________,溶液的pH_________(填“增大”“减小”“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:____________;所得溶液的pH_________7(填“>”、“<”或“=”),用离子方程式表示其原因________。
(3)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺是_______
(4)实验室可用向浓氨水中加入CaO的方法制取氨气,从氨水中存在的平衡入手分析产生NH3的原因:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
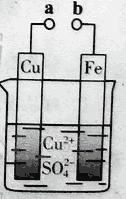
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH5属于离子晶体。与水反应的化学方程式为:NH5+H2O→NH3H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。有关NH5叙述正确的是( )
A.与乙醇反应时,NH5被氧化
B.NH5中N元素的化合价为+5价
C.1molNH5中含有5molN-H键
D.1molNH5与H2O完全反应,转移电子2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地湖盐中含有Ca2+、Mg2+、Fe3+、SO42-等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:

(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是__________。
(2)过程Ⅱ的目的是除去SO42-,加入的X溶液是__________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/100gH2O]
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
①过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3外还有__________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为__________。
(4)上述精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,除去这些离子及进行电解的流程如下:
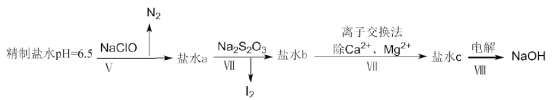
①过程V生成N2的离子方程式为__________。
②过程Ⅳ可以通过控制Na2S2O3的量,将IO3-还原成I2,且盐水b中含有SO42-,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为__________。
③在过程Ⅳ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O。为了测定其含Na2S2O3·5H2O的纯度,称取8.00g样品,配成250mL溶液,取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol·L-1的碘水滴定(发生反应2S2O32-+I2=S4O62-+2I-),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图所示装置做实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
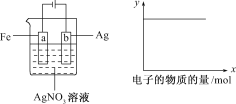
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③B.③④
C.①②④D.①②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com